年营收数千亿元,mRNA厚积薄发(中)丨贝研报 06
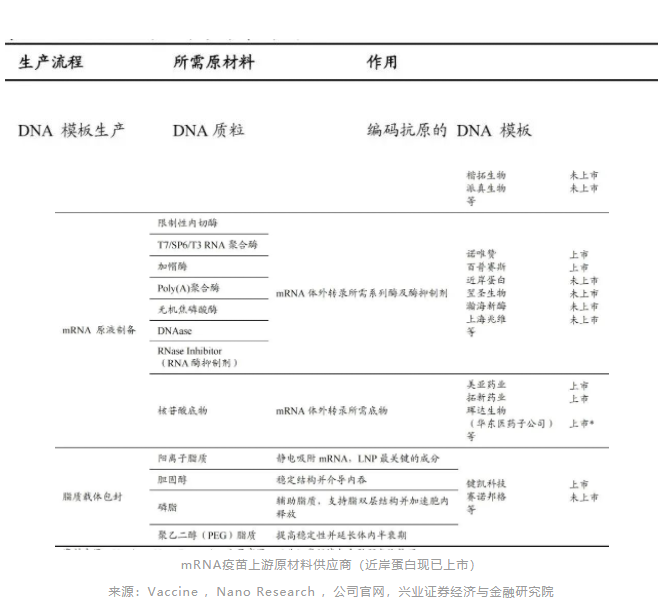
获得高纯度超螺旋质粒为生产关键指标。从大肠杆菌中提取的质粒中,DNA会以多种形式存在,如超螺旋质粒DNA、开环DNA、线性DNA和质粒DNA聚集体等,往往需要的目标产物为超螺旋质粒DNA,用于后续线性化的质粒超螺旋结构占比需要达到90%以上,然而由于其他DNA杂质也有非常相似的纯化特点,因此获得高纯度的超螺旋质粒产物具有较大挑战。
2) mRNA原液制备:该阶段主要是通过体外转录技术(InVitroTranscription,IVT)以上一阶段的线性DNA为模板制备mRNA。主要工艺环节包括将线性化质粒DNA转录为mRNA、化学修饰(包含5'端加帽结构(Cap)和3'-polyA加尾结构)、分离纯化、mRNA原液分装冻存。
加帽结构可有效提高mRNA翻译效率及稳定性。PolyA结构可以让mRNA在细胞中免受核酶的降解,增强mRNA的稳定性,同时polyA结构长度可以控制转录效率。
3) mRNA制剂制备:关键的制剂技术突破解决了mRNA的成药性问题。mRNA制剂的主要工艺环节包括mRNA的包封/装载、复合物纯化、除菌过滤、无菌灌装等;其中,包封/装载工艺的基础是递送系统的设计开发。
4) 质量控制同样是形成安全、有效疫苗制剂的关键。在此过程中,主要使用毛细管电泳、液相色谱、液相色谱串联质谱系统以及冷冻电镜等仪器对DNA转录模板、mRNA和mRNA-LNP制剂进行多种检测。
根据药典要求,mRNA原液检测要点超18项,mRNA制剂检测要点超22项,整体检测流程较为复杂且成本较高。
目前mRNA的检测项目中技术门槛最高的当属加帽率的检测部分,加帽率目前通用的检测方法为LC-MS,整体检测流程较为复杂。由于完整的mRNA链分子量较高,利用LC-MS难以进行精准定量,故一般采用生物素标记探针利用磁珠吸附mRNA链后,实现与杂质的分离,随后加入剪切酶将mRNA链切断,进而对5'端帽子结构在LC-MS仪器中进行精确定量测定。
不过,由于不同mRNA药物具有特殊的分子序列,故探针需要定制化生产,检测方法也需要针对不同的mRNA分子专项开发,因此整体检测难度较高。
2)提高疫苗供应链保障水平。支持疫苗企业和重要原辅料、耗材、生产设备、包装材料企业协作,提高各类产品质量技术水平。
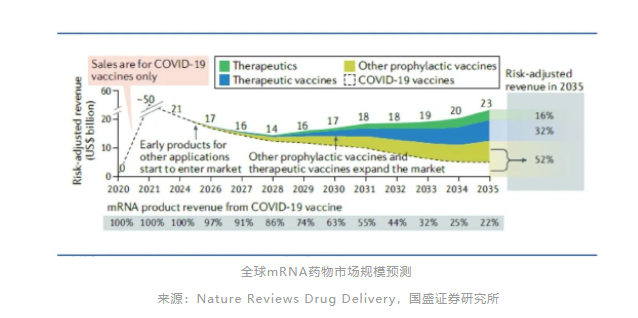
其他mRNA预防性疫苗、治疗性疫苗的逐步收获将推动整体mRNA药物市场规模触底反弹,预计2028-2035年间的CAGR为6.4%。
长期来看,预计2035年新冠肺炎疫苗营收比例下降至22%,其他传染性疾病mRNA疫苗占比30%,治疗性疫苗占比32%,治疗性mRNA药物比例16%。
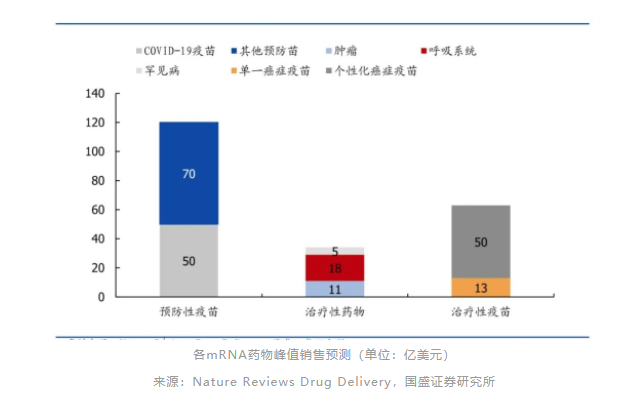
根据不同适应症目标人群的渗透率、定价水平和同类竞争情况,Nature对各类mRNA药物的峰值销售预测如下:
1、预防性mRNA疫苗有望在未来15年占据市场主流。
该类产品(除COVID-19疫苗外)平均全球销售额峰值约为8亿美元;
到2035年,预防性mRNA疫苗总市场规模(经风险调整)为70-100亿美元(不包括COVID-19疫苗)和120-150亿美元(包括COVID-19疫苗);
短期内,预防性疫苗的大部分收入仍将来自COVID-19产品;中长期来看,用于呼吸道合胞病毒和流感等疾病的其他疫苗可能覆盖更广泛的人群,但价格上行空间有限。
2、治疗性mRNA疫苗商业潜力来自患者群体规模,并有望在靶向多种肿瘤相关抗原的治疗模式中占据主导地位。
由于临床开发、监管和制备风险,该类产品的整体渗透率可能相对较低;
预计个性化癌症疫苗产品的平均销售峰值约为50亿美元,针对单一疾病产品的销售峰值约为13亿美元;
到2035年,治疗性mRNA疫苗总体市场规模(经风险调整)有望达到70-100亿美元;
但治疗性疫苗仍面临一定的挑战:
1)针对患者的早期治疗与另一种免疫肿瘤药物联合,可能需要较长的随访时间,及与免疫肿瘤单药治疗需要进行头对头临床试验;
2)个性化疫苗制备周期长(1-3个月),需优化生产工艺和商业化渠道。
3、治疗性mRNA药物目标适应症类型多样,有望成为mRNA药物的明星领域。
治疗性mRNA药物预计将占mRNA产品10%—30%的份额,2035年整体市场规模(风险调整后)为4—50亿美元;
肿瘤、呼吸系统疾病(囊性纤维化为主)和罕见病全球管线产品平均销售峰值分别约为11亿美元、18亿美元和5亿美元;
值得一提的是,治疗性mRNA药物的长期前景将取决于递送系统、基因编辑技术的进步。
总体而言,在递送技术和稳定性方面取得改善和进步以后,mRNA具有非常强的竞争优势,有潜力成为跨应用领域的产品。
此外,mRNA药物开发还可针对部分现在难以成药的靶点,进一步扩大治疗领域。
2020年12月,Moderna新冠mRNA疫苗产品Spikevax获美国FDA紧急使用授权,并于2022年1月正式获批。2021年度,Spikevax发放支数超过8亿剂,创造营收177亿美元。
除新冠疫苗外,Moderna还积极布局肿瘤疫苗及其他治疗性药物研发。2018年,Moderna和默沙东达成合作,开发个性化肿瘤疫苗mRNA-4157。该疫苗可以编码34种肿瘤新抗原,并在头颈癌中收获积极结果。1期临床研究数据显示,mRNA-4157与K药联用治疗HPV阴性的头颈部鳞状细胞癌,总缓解率(ORR)为50%,疾病控制率(DCR)为90%,mPFS达到9.8个月。
在罕见病治疗领域,Moderna积极研发丙酸血症(PA)、甲基丙二酸血症(MMA)、糖原贮积病(GSD1α)、苯丙酮尿症(PKU)和囊性纤维化(CF)的mRNA疗法;局部再生疗法中,针对心肌缺血的VEGF-A编码mRNA疗法已进入临床2期研究阶段。
Moderna凭借在mRNA领域的领先实力,已与全球多家头部药企、政府机构、基金会及研究机构达成广泛合作,包括AstraZeneca、MERCK、VERTEX、Bill&MelindaGatesFoundation等。
BioNTech
BioNTech成立于2008年,目前共有5款产品处于2期临床研究阶段,15款产品处于1期临床,12款产品处于临床前研究阶段;其中21款产品为mRNA药物。
2020年,BioNTech与辉瑞合作,率先研制出新冠mRNA疫苗,并在2021年创造了404亿美元的销售额。
据BioNTech发布报告,目前公司共有5大技术平台:Deepunderstandingoftheimmunesystem(免疫系统平台)、Targetdiscoveryandcharacterization(靶点发现平台)、Multi-platforminnovationengine(多平台创新引擎)、Digital&AI/ML(人工智能平台)以及Manufacturingandautomation(生产和自动化平台)。
免疫系统平台:针对mRNA在人体蛋白调控以及基因表达过程中发挥的重要作用制备传染病疫苗、肿瘤疫苗、CAR/TCR等细胞疫苗以及下一代免疫调节因子;
靶点发现平台:针对突变导致肿瘤异质性,利用突变位点的免疫原性进行肿瘤疫苗开发;
多平台创新引擎:联合mRNA疫苗、细胞和基因疗法、靶向抗体技术、小分子免疫调节剂以及下一代免疫调节剂等技术,在抗击肿瘤和传染病方面,探寻更多可能的治疗方案;
人工智能平台:AI预测肿瘤抗原以及新冠突变体;
生产和自动化平台:具备端到端mRNA疫苗的全部生产能力,在全球拥有多个研发中心。
除开发mRNA疫苗应对当下新冠疫情外,BioNTech更在癌症研究领域高度聚焦。
2021年10月,BioNTech宣布与基因泰克(Genentech)合作开发个体化mRNA癌症疫苗BNT122(RO7198457),在治疗结直肠癌的2期临床试验中已完成首例患者给药。据悉,BNT122是一种个体化的新抗原特异性免疫疗法(iNeST),含有未修饰、药理学优化的mRNA,能编码多达20种患者特异性新抗原。
CureVac
CureVac成立于2000年,在mRNA领域深耕20余年,与Moderna、BioNTech同属全球mRNA技术领域第一梯队。
2021年6月,CureVac新冠mRNA疫苗2b/3期临床试验HERALD研究结果公布,结果显示CVnCoV新冠疫苗对于预防COVID-19仅有47%的保护力,不符合预先设定的统计学标准。目前,CureVac的研究重心在于下一代冠状病毒mRNA疫苗和癌症疫苗。
同时,CureVac也在积极寻求合作扩充其产品管线。2022年5月,CureVac与myNEO达成协议,寻找肿瘤细胞表面的新抗原,以开发基于mRNA的癌症疫苗;2022年6月,以3200万欧元收购荷兰肿瘤免疫疗法公司FrameCancerTherapeutics,进一步加强在肿瘤免疫疗法领域的布局。
敬请期待《年营收数千亿元,mRNA厚积薄发(下)》
(了解更多详情,关注:VXGZH-贝壳社)
2.国信证券:国内mRNA疫苗管线进展梳理——疫苗行业2022H1数据跟踪
3.沙利文:核酸药物市场产业现状与未来发展报告
4.国盛证券:医药生物创新药周报:mRNA迎风起势,海内外研发同入快车道
5.破茧成蝶:康德赛mRNA编辑DC个性化肿瘤疫苗IND正式受理
6.财通证券行业专题报告:核酸药物行业新闻双周报
7.中泰证券:商业化时代来临,mRNA技术有望迎来黄金十年
8.mRNA疫苗:当前趋势和前景
9.一文尽览:mRNA疫苗市场全景
10.兴业证券:疫苗行业景气度向上,新冠疫苗研发加速国产企业技术攻坚
11.国内首款mRNA编辑DC肿瘤疫苗IND获得受理
12.民生证券:mRNA产业迎来历史机遇,国产力量加速崛起
13.专访新合生物丨新抗原预测准确率高达70%,基于AI+mRNA技术开发肿瘤新抗原疫苗,联合疗法或将成为主流方案
14.沃森生物/蓝鹊生物:新冠mRNA疫苗将启动一期临床
15.盘点国内8家mRNA企业
16.国内16款新冠mRNA疫苗汇总!自研14款,引进2款
17.爆!晚期癌症转移患者完全缓解!CAR-T联合mRNA疫苗获欧洲药监局优先药物资格!
18.mRNA疫苗巨头Moderna正式进入基因编辑领域,剑指下一代体内基因编辑疗法
19.LNP递送CRISPR-mRNA在体基因编辑的最新应用盘点
20.海通国际:mRNA——体内药物工厂“施工图”,不仅仅是疫苗
21.世界首次!利用mRNA疫苗强化CAR-T细胞,晚期实体瘤患者癌症转移得到完全缓解


文章评论(0)