年营收数千亿元,mRNA厚积薄发(下)丨贝研报 06
作者丨贝壳研究院
(3)制药企业:石药集团、复星医药(参股BioNtech,并与BioNtech设立合资公司)、丽珠集团(参股丽凡达)等。
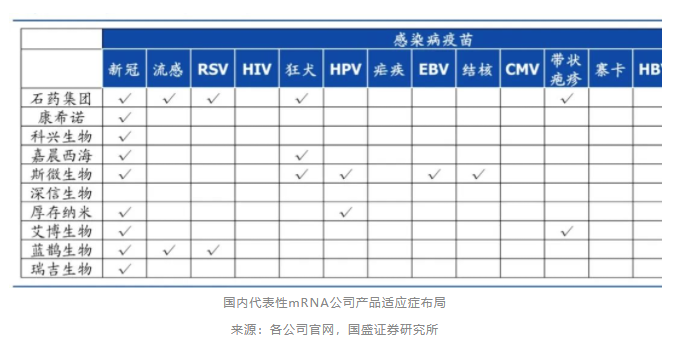
布局产品如下:
2022年5月,ARCoV在中国成人中作为加强针使用的研究数据在medRxiv平台发布。
针对Omicron变异株,接种28天后受试者的抗体平均滴度下降幅度较大,为28.1,但仍明显高于同源加强组的6.4。异源加强组83.75%的参与者达到了针对Omicron的中和抗体滴度1:8的阈值,而同源加强组中只有35%;
斯微生物
斯微生物为国内率先开展mRNA药物研发生产的平台型企业之一,拥有自主知识产权的mRNA脂质多聚体纳米递送技术平台(LPP/mRNA),同时自主开发了基于云计算技术的抗原分析、预测、序列优化平台,并拥有完整的mRNA疫苗分析及质控技术平台。
从产品管线来看,斯微生物全面布局人用预防性疫苗、肿瘤疫苗、抗体药物、动物保健、蛋白替代疗法以及医学美容等领域,目前20余项研发管线涵盖mRNA传染性疾病疫苗和癌症疫苗。
其中,迭代抗新冠变异株mRNA疫苗已于2022年4月获NMPA批准开展临床试验,个性化肿瘤mRNA疫苗也已于2022年2月在澳大利亚进入临床Ⅰ期研究阶段。目前,斯微生物已经在上海周浦和奉贤建成现代化生产工厂,可实现4亿剂/年的产能。
 斯微生物已经完成多轮融资,包括君实生物在内的3000万元A+轮融资,后又获得了西藏药业3.51亿元的战略投资。斯微生物创始人李航文为贝壳学社校友。
斯微生物已经完成多轮融资,包括君实生物在内的3000万元A+轮融资,后又获得了西藏药业3.51亿元的战略投资。斯微生物创始人李航文为贝壳学社校友。
艾美疫苗/丽凡达
2021年3月,艾美疫苗新冠mRNA疫苗LVRNA009的临床试验申请获得NMPA批准,是继艾博生物和斯微生物之后的第三款获批临床试验的国产mRNA新冠疫苗。
2022年1月,LVRNA009疫苗Ⅰ期临床试验数据显示其安全性和耐受性良好,未发生三级以上的不良事件。同时,活病毒中和抗体检测结果显示“成人低剂量组第56天的GMT超570,成人中剂量组第56天的GMT超1500,成人高剂量组第56天的GMT超840”。与同类产品的Ⅰ期临床试验结果相比,LVRNA009疫苗显示出非常好的安全性和免疫原性。
产业化方面,据悉艾美疫苗目前正在多地布局mRNA疫苗的模块化生产车间。工厂预计2022年年底建成,2023年投产,年产能预计4亿剂。
此外,艾美疫苗还在开发一款新型冠状病毒delta变异株mRNA疫苗,处于临床前研究阶段。
瑞吉生物/瑞科吉生物
瑞吉生物研发的冻干新型冠状病毒奥密克戎株mRNA疫苗RH109由下设合资公司(武汉瑞科吉生物科技有限公司)分别在新西兰和菲律宾获得临床批件。本次获批,标志着全球首款冻干型新冠奥密克戎株mRNA疫苗进入临床阶段。
据悉,该疫苗采用LNP递送系统,应用自主开发的冷冻干燥技术实现了4℃和25℃条件下的制剂稳定性,这也表明,该疫苗可在常规冷链条件下贮存与运输,极大地提高疫苗接种可及性。
临床前研究表明,该疫苗针对奥密克戎变种病毒能产生有效保护,作为加强针使用可诱导广谱交叉中和反应,显示其良好的免疫原性特征。目前,相关研究结果已在预印本平台bioRvix发布。
石药集团
2022年4月,石药集团发布公告,宣布其新冠mRNA疫苗SYS6006的临床试验申请已经获得NMPA批准。根据公告信息,SYS6006为针对新冠病毒变异株的mRNA疫苗,对Omicron、Delta在内的当前主要突变株都具有良好的保护效力。
此外,SYS6006的稳定性好,可以在2—8℃长期保存。
同时,石药集团对mRNA技术的关键生产原料和辅料实现了内化生产和国产化替代,可满足大规模产能供应需求。
沃森生物/蓝鹊生物/复旦大学
2022年9月,蓝鹊生物联合复旦大学、沃森生物联合研发的新型冠状病毒变异株mRNA疫苗(S蛋白嵌合体)(代号:RQ3013)的临床试验申请获得NMPA批准。
RQ3013是国内首个进入临床的mRNA嵌合体疫苗,编码新冠病毒S全长蛋白并嵌合了多个变异株关键突变位点,序列中含有多个奥密克戎株突变位点。
临床前研究表明,该疫苗具有良好的安全性和保护效果,对包括Omicron株在内的主要新型冠状病毒VOCs均具有一定的交叉中和能力。
海昶生物
海昶生物新冠mRNA疫苗加强针项目(HC009)已完成美国FDA的IND申请。该产品将用于预防包括奥米克戎在内的多种变异株感染,适用于前期已接种初始序列新冠疫苗的人群。
海昶生物将开展新冠疫苗加强针临床试验,在验证HC009安全性、耐受性以及免疫原性之后,将以适应性设计的方式推进国际多中心临床试验,加速审批和商业化。
康希诺生物
2022年9月,康希诺生物吸入用重组新型冠状病毒疫苗(5型腺病毒载体)克威莎®雾优®,经国家卫生健康委提出建议,国家药品监督管理局组织论证同意作为加强针纳入紧急使用。
克威莎®雾优®在肌注型腺病毒载体新冠疫苗克威莎®的基础上创新给药方式,用雾化器将疫苗雾化成微小颗粒,通过口腔吸入的方式完成接种。该接种过程无需针刺,一呼一吸间即可获得高效免疫保护。
2021年3月,克威莎®雾优®的临床试验申请获得NMPA批准,适应症为预防新型冠状病毒感染所致疾病(COVID-19)。相关临床数据已在国际顶尖医学期刊《柳叶刀》发表。
研究表明,克威莎®雾优®不仅能激发体液免疫和细胞免疫,还可高效诱导黏膜免疫,实现三重保护,阻断感染和传播。
中生复诺健
2022年6月,中生复诺健针对奥密克戎变异毒株研发的mRNA疫苗已向CDE(国家食品药品监督管理局的药品审评中心)滚动提交临床申报资料,有望进入临床研究。
康华生物/信然博创
康华生物与信然博创基于mRNA技术平台达成合作,以便研究开发带状疱疹疫苗、肺结核疫苗和狂犬疫苗。康华生物致力于疫苗和生物制品研发、生产、销售,拥有工艺放大、应用研究优势以及在疫苗注册、临床研究、产业化和市场推广方面拥有丰富的经验和核心能力。信然博创拥有mRNA疫苗技术开发的技术优势。
康华生物通过与信然博创合作进行mRNA疫苗开发,有利于其建立mRNA疫苗技术平台,进一步拓展公司研发产品线。
威斯津生物
威斯津生物于2021年7月创立,目前该团队开发了针对奥密克戎(Omicron)以及德尔塔(Delta)等新冠变异病毒的mRNA疫苗,并向国家药品监督管理局申请新药临床研究审批。
威斯津项目依托生物治疗国家重点实验室,由中科院魏于全院士和川大博士生导师宋项容担任联合创始人,目前公司产品管线拥有包括病毒疫苗、肿瘤疫苗、抗衰老疫苗、肥胖疫苗、肺纤维化治疗、基因编辑及新型佐剂在内的近20个mRNA药物和疫苗佐剂品种。
复星医药
由复星医药和BioNTech合作开发的mRNA新冠疫苗复必泰于2021年3月被纳入香港特别行政区政府、澳门特别行政区政府接种计划,2021年9月在台湾省开展接种。
截至2022年2月末,该款疫苗的销售量已达2206万剂,贡献收入超过10亿元。
云顶新耀
云顶新耀通过与Providence合作,引进新冠mRNA疫苗PTX-COVID19-B,Ⅰ期临床数据显示,接受过PTX-COVID9-B治疗的受试者血清在第28天显示出中和活性,而接受安慰剂治疗的受试者均未产生中和抗体。在第二次注射两周后,中和抗体滴度随着剂量的增加和时间的推移而增加。第42天的中和效价比新冠康复患者的中和水平高出10倍以上。
与此同时,云顶新耀和Providence还在开发针对Omicron的下一代mRNA疫苗。
锐博生物/阿格纳生物
2021年11月,由锐博生物和阿格纳生物申请的新冠mRNA疫苗临床试验申请获得NMPA批准。2022年1月,该疫苗Ⅰ期临床试验正式启动。
康德赛
2022年8月,康德赛自主研发的个体化树突状细胞CUD002注射液临床试验的申请已获受理,用于治疗晚期卵巢癌,该产品为中国首款基于患者肿瘤新生抗原的mRNA编辑DC肿瘤疫苗。
康德赛与战略伙伴裕策生物(贝壳基金投资企业)紧密协同,建立了自主产权的新生抗原筛选与验证体系,利用新颖的新生抗原靶点和免疫调节因子的组合方式,具有优异的肿瘤杀伤效果。
新合生物拥有自主知识产权的肿瘤新抗原预测系统Neo Cura AI ALPINE,并汇集大量数据作为靶点预测的算法基础。除了新抗原预测系统,还建立起多个技术平台及算法平台,从最早期的核酸修饰,到序列优化,再到不同载体、以及递送系统的优化等,深入各个研发环节加速现有产品的研发进程及支持后续管线开发的延展性。
2021年12月,新合生物宣布完成5亿元A+轮融资。该轮融资由人保资本和著名投资人&新合生物联合创始人周亚辉联合领投,国管中心旗下顺禧基金、佳银基金、鼎晖投资和老股东跟投。
厚存纳米
厚存纳米是国内较早专注于mRNA纳米递送、mRNA病毒疫苗、mRNA肿瘤疫苗药物研发的企业。与上海细胞治疗集团已基本完成mRNA纳米递送研发平台的建设,摸清mRNA体外合成的技术路线,并完成裸鼠体内的表达效果验证。
厚存纳米后续将借助中国科学院深圳先进技术研究院、香港大学等平台,加快验证mRNA合成平台、mRNA递送平台以及mRNA疫苗的体内免疫效果,进一步推动新冠mRNA疫苗研发。
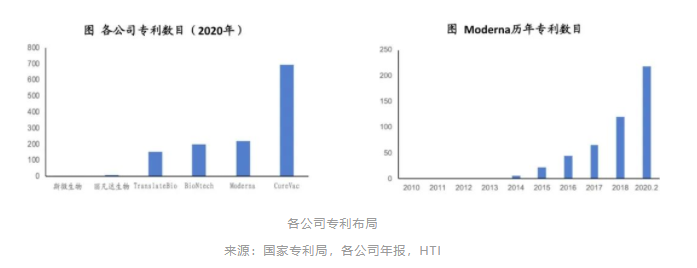
mRNA三巨头专利布局领先
欧美mRNA公司均拥有较多的专利技术,特别是mRNA三巨头均有超过200个以上的专利,覆盖mRNA的递送系统及mRNA的改造等技术。国内mRNA公司在专利布局上尚处于落后状态。
以Moderna为例,已花费超5亿美金用于提升其技术平台和知识产权,涉及优化mRNA序列的方法、专为增强mRNA药物的稳定性和体内性能而设计的工程元素、LNP递送系统、用于制造和分析mRNA原料药和配方药物的创新方法等。公司专利数量仍在保持每年快速增长。

从产品管线看,除新冠疫苗外,国内自研mRNA药物均处于早期研发阶段,但已在逐渐覆盖传染病预防、肿瘤治疗等疾病领域,管线初具雏形;海外mRNA药物管线更为丰富,相关企业产品布局呈现平台化。尤其在肿瘤疫苗、治疗性药物研发中进度领先,更实现与CAR-T、基因编辑等前沿技术的巧妙结合,为行业发展挖掘全新机遇。
以mRNA疫苗为例,生产过程中主要涉及到分子结构设计、递送系统的优化、生产工艺放大等诸多环节,每个环节都有一些技术壁垒或者工艺难点需要解决。由于mRNA分子的脆弱性,目前尚未完全实现裸露mRNA药物注射进人体内从而发挥作用,因此找到合适的递送系统便成为最关键的部分,也是一家企业的技术实力和壁垒体现。另外,找到合适的递送系统后,仍需要优化序列水平以提高mRNA的翻译效率,同时需要企业摸索具体工艺参数,形成稳定的供货体系。
近期,国内多款新冠候选mRNA疫苗密集获批临床或更新临床数据,各个产品在抗原设计、递送系统和制剂工艺等方面各具特色,在Omicron变异株大流行背景下,有望与基于原始株设计的获批疫苗产品进行差异化竞争,也是对现有防疫体系的良好补充,同时也有望利用新冠疫苗管线快速走通mRNA疫苗研发和生产平台。
(了解更多详情,关注VXGZH:贝壳社)
参考资料:
1.mRNA技术概览
2.国信证券:国内mRNA疫苗管线进展梳理——疫苗行业2022H1数据跟踪
3.沙利文:核酸药物市场产业现状与未来发展报告
4.国盛证券:医药生物创新药周报:mRNA迎风起势,海内外研发同入快车道
5.破茧成蝶:康德赛mRNA编辑DC个性化肿瘤疫苗IND正式受理
6.财通证券行业专题报告:核酸药物行业新闻双周报
7.中泰证券:商业化时代来临,mRNA技术有望迎来黄金十年
8.mRNA疫苗:当前趋势和前景
9.一文尽览:mRNA疫苗市场全景
10.兴业证券:疫苗行业景气度向上,新冠疫苗研发加速国产企业技术攻坚
11.国内首款mRNA编辑DC肿瘤疫苗IND获得受理
12.民生证券:mRNA产业迎来历史机遇,国产力量加速崛起
13.专访新合生物丨新抗原预测准确率高达70%,基于AI+mRNA技术开发肿瘤新抗原疫苗,联合疗法或将成为主流方案
14.沃森生物/蓝鹊生物:新冠mRNA疫苗将启动一期临床
15.盘点国内8家mRNA企业
16.国内16款新冠mRNA疫苗汇总!自研14款,引进2款
17.爆!晚期癌症转移患者完全缓解!CAR-T联合mRNA疫苗获欧洲药监局优先药物资格!
18.mRNA疫苗巨头Moderna正式进入基因编辑领域,剑指下一代体内基因编辑疗法
19.LNP递送CRISPR-mRNA在体基因编辑的最新应用盘点
20.海通国际:mRNA——体内药物工厂“施工图”,不仅仅是疫苗
21.世界首次!利用mRNA疫苗强化CAR-T细胞,晚期实体瘤患者癌症转移得到完全缓解


文章评论(0)