曙光与寒意并存,百亿NASH药物何时迎来突破?
放眼全球,NAFLD全球患者人群庞大,预计到2030年,全球将有19亿成人患有NAFLD,其中5亿人将发展成为NASH。据弗若斯特沙利文预测,到2025年全球NASH药物市场将达到107亿美元,并于2030年达到322亿美元,期间复合年增长率为41.8%和24.6%。
种种迹象表明,NASH药物市场正在成为一条火热赛道。但是,NASH的复杂性使得40年的新药研究虽曙光不断,但屡屡溃败。最近,被誉为NASH药物标杆的奥贝胆酸的上市申请再次遭到FDA拒绝,为行业注入寒气。拥有百亿市场的NASH,出路在哪里?
寒意不仅止于奥贝胆酸,也并非仅存在于今日。早在2019年6月,诺华宣布FXR激动剂emricasan治疗NASH的2b期研究ENCORE-LF鉴于临床失败将停止患者治疗;2020年10月,鉴于引发疾病风险,辉瑞在三季报中宣布砍掉处于2期临床的治疗NASH的ACC1/2 双重抑制剂PF-05221304;2020年,Genfit公司的elafibranor在3期试验中失败;吉利德的ASK1抑制剂selonsertib也在两项临床试验失败后宣布终止……
接连不断的失败不断验证着NASH赛道的残酷。但基于不断扩大的市场,国内外药企似乎愈挫愈勇,布局者颇多。据医药魔方NextPharma数据库,全球针对NASH开展的临床试验多集中在临床I期和II期,分别有74例、73例,临床III期的开展数量有15例。在研新药主要针对糖代谢、脂质代谢、胆固醇代谢、抗炎、抗纤维化5类靶点。根据靶点主要可以分为以下几类:FXR激动剂、THR-β激动剂、GLP-1R激动剂、PPAR激动剂、ACC抑制剂、FGF19和FGRF21类似物、CCR2和CCR5拮抗剂等。其中,FXR和THR-β靶点药物因相对丰富的临床数据而被看好。
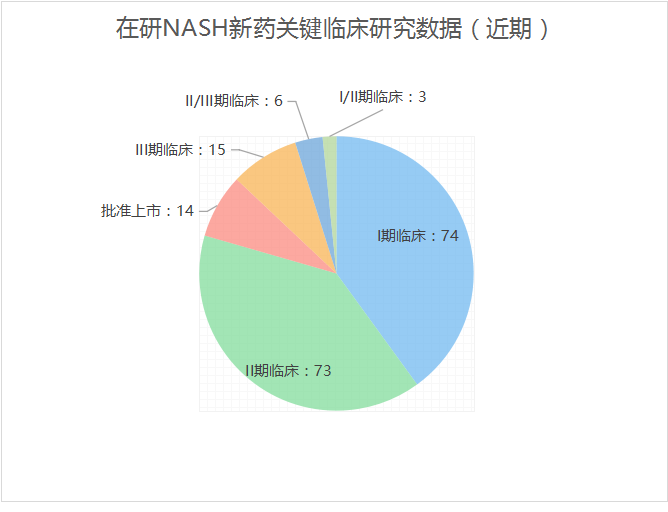
来源:医药魔方NextPharma数据库
制图:贝壳社
国外布局企业中,除了Intercept,还有Madrigal和Akero。
Intercept奥贝胆酸上市被拒,给了Resmetirom更多撞线机会。Madrigal的THR-β激动剂Resmetirom是从罗氏引进的甲状腺激素受体β亚型(THR-β)激动剂。2022年12月19日,Madrigal宣布Resmetirom用于治疗NASH的III期MAESTRO研究达到了双重主要终点。结果显示Resmetirom除了缓解NASH外,还能改善心血管指标。此外,安全性方面,针对治疗初期最常见的轻中度腹泻和恶心等不良反应,Resmetirom的效果超出很大预期。也因此,Resmetirom股价暴涨234.68%,市值超过40亿美元。今年4月份,Resmetirom被FDA授予治疗伴有肝纤维化的非酒精性脂肪性肝炎(NASH)患者的突破性疗法认定。上市申请方面,Madrigal表示将在今年上半年提交Resmetirom用于非肝硬化NASH伴肝纤维化治疗的新药上市申请。若成功,该药将成为NASH药物赛道的“上市第一名”。
美国Akero Therapeutics开发的Efruxifermin是一款长效FGF21类似物,于去年9月公布IIb期临床结果:该药物可以改善41%受试者肝纤维化程度,刷新NASH新药有效性数据。安全性方面,Efruxifermin最常见的不良反应是腹泻(高剂量组33%)和恶心(高剂量组33%)。基于上述数据,Akero Therapeutics预计将于2023年下半年开始招募III期研究患者。
除此,诺和诺德的“减肥神药”GLP-1司美格鲁肽(Semaglutide)在NASH药物研发领域走在前列。公告显示,司美格鲁肽在治疗NASH的II期临床中结果积极,66.7%患者的NASH症状得到消除;改善患者肝纤维化方面,在接受最高剂量司美格鲁肽治疗的患者中,有5.8%的患者肝纤维化出现进展(安慰剂组为21.4%)。目前,诺和诺德已在中国启动司美格鲁肽用于NASH的3期国际多中心临床试验。
在国内,目前布局NASH药物的企业不在少数,有歌礼制药、众生药业、正大天晴、四环医药、石药集团、拓臻生物、微芯生物、雅创医药、圣和药业、豪森药业等。
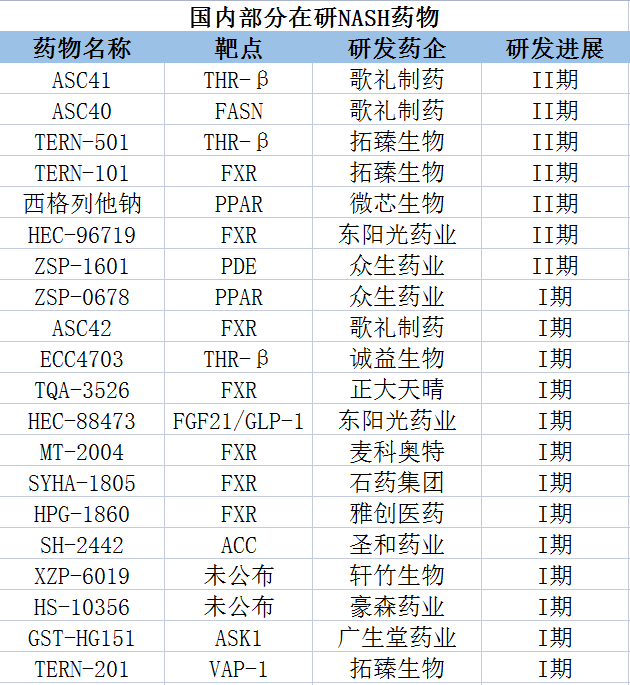
来源:根据公开资料整理
制图:贝壳社
另外,君圣泰的NASH在研项目以创新分子HTD1801为基础进行新药研发,是该领域中国首个获得FDA授予快速通道资格认定的创新药,已在美国完成lla期临床试验,试验结果达到首要终点及多个关键次要终点。今年3月,拓臻生物开发的THR-β靶点管线TERN-501启动了单药以及与FXR激动剂TERN-101联合用药的II期临床。NASH在研新药方面,拓臻生物还布局了FXR激动剂TERN-101、VAP-1抑制剂TERN-201等。微芯生物西格列他钠单药治疗NASH的II期临床试验于2022年3月21日在组长单位北京友谊医院完成首例病人入组,预计今年能完成入组。
此外,正大天晴的TQA3563、石药集团的SYHA1805、雅创医药的HPG-1860、圣和药业的SH-2442、豪森药业的HS-10356等均进入临床试验阶段。
不难看出,虽然NASH在实际临床设计与实施中存在种种困难与挑战,且根据统计II期以上NASH新药管线有三分之一失败,但面对巨大的市场蛋糕,各企业动作频频。不过,如何在NASH药物市场找到突破、抢占市场,是每家入局者都要考虑的问题。
糖肝共治与联合疗法。非酒精性脂肪性肝病和糖尿病是同根同源、互为危险因素的两类疾病。临床中,非酒精性脂肪性肝病(NAFLD)同时合并有2型糖尿病的病人明显增多。目前中国成人2型糖尿病合并NAFLD患者人数超过6000万。国内外均有企业针对NASH开展糖肝共治与联合治疗,成果显著。
譬如上文提到的歌礼制药披露的Ib期临床数据显示,ASC41在20名超重和肥胖受试者(此类人群具有NAFLD特征)中,效果较为显著。今年6月5日,Akero Therapeutics宣布efruxifermin(EFX)治疗2型糖尿病和非酒精性脂肪性肝炎(NASH)伴纤维化F1-F3期的IIb期SYMMETRY研究(队列D)取得积极结果。结果显示,EFX联合GLP-1治疗12周的患者肝脏脂肪较基线减少65%,而单独GLP-1治疗的患者肝脏脂肪相对减少10%。此外血糖控制以及血脂方面均有统计学意义的改善。君圣泰创新分子HTD1801,在NASH适应症外,还拓展了2型糖尿病(T2DM)适应症。
今年6月,默沙东宣布其GLP-1R/GCGR双靶点激动剂Efinopegdutide最近被FDA授予快速通道资格,用于治疗NASH。此外,阿斯利康的Cotadutide和勃林格殷格翰的BI456906在相同靶点上进入NASH临床。前文提到的拓臻生物于今年3月在开发的THR-β靶点管线TERN-501上同时启动了与FXR激动剂TERN-101联合用药的II期临床。雅创医药也表示将启动FXR激动剂HPG1860和THR-β激动剂HPG7233两款药物的联合用药项目。
值得一提的是,科兴制药的独家抗病毒中成药产品克癀胶囊已纳入《老年非酒精性脂肪性肝病慢病管理指南》,目前新产线正式投产,开始在院内以新的价格体系进行销售。此外,科兴制药将发起并开展非酒精性脂肪肝临床科研与疾病管理大数据共享平台大型队列战略合作项目(NAFLD项目)。
一个奥贝胆酸倒了,无数个“奥贝胆酸”正在赶来的路上。到底谁将成为NASH药物赛道“上市第一名”,我们拭目以待。
参考资料:
1.《减肥神药GLP-1的下一个百亿市场——NASH》,见智研究,2023-06-14.
2.《奥贝胆酸NASH适应症延迟获批,距离NASH成功还有多远?》,凯莱英药闻,2023-05-28.
3.《再度折戟:奥贝胆酸又遭FDA拒绝批准!百亿美金NASH市场,国内研发版图几何?》,药渡,2023-06-26.
4.《君圣泰2023欧肝会展示原创新药降低NASH患者cT1临床数据》,投资界,2023-06-25.
5.《众生药业NASH一类创新药ZSP1601片Ⅱb期临床试验全国研究者会胜利召开并迎来首例入组》,看头条网,2022-06-05.


文章评论(0)