全球超300项临床试验被”暂停”,这五大策略值得一看
但是非COVID-19试验呢?据报道,受试验站点关闭或入组患者减少的影响,大量研发计划已按下了暂停键。截至4月3日,辉瑞、BMS、礼来等大型跨国药企以及包括Moderna Therapeutics、Iveric Bio在内的生物技术公司已公开宣布修改其研发计划。
全球临床试验危机已不言而喻。生命科学行业市场咨询公司Evaluate旗下Vantage公司一项测算显示,估计全球将会有315项临床试验研究因疫情影响而延迟,这些研究原定将于今年年底到期,涉及逾17万个受试者,涉及金额可能高达200亿美元。
数据来源:Medidata Solutions
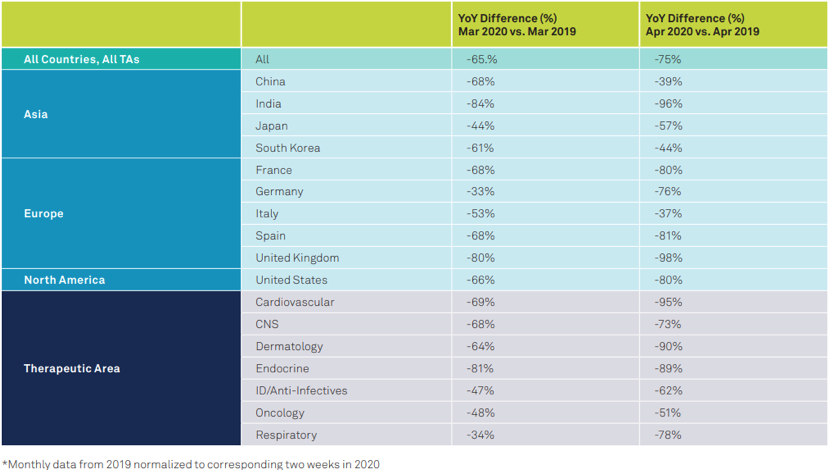
从这份调查中不难发现,COVID-19大流行使得全球大多数国家的患者入组招募人数较去年同期急剧下降。具体来看,在4月份的前两周中,只有中国、韩国和意大利患者入组人数的下降趋势有所减缓,其他国家的患者入组情况受疫情的影响依旧在继续扩大,其中印度和英国这一下降比例甚至高达96%和98%。
细分领域层面,肿瘤药物试验受到影响相对较小,其在2020年4月份前两周的同比下降比例为51%,但心血管和皮肤病药物的研究受到的影响尤为明显,同比下降比例分别为95%和90%。
这一背景下,有没有一些策略可减轻COVID-19大流行所带来的全球临床试验危机?4月27日,Parexel International公司全球临床运营副总裁Jenny Gidley,公司副总裁Alberto Grignolo在《Five strategies for mitigating the impact of COVID-19 on clinical trials》一文中提出,虚拟试验(利用数字医疗技术并允许患者在家中参与)和混合试验(将随机化盲法对照试验与现实世界的数据结合起来)的速度,效率和成本节省,可能会永久改变临床试验的前景。此外,他们还提出了应对当前临床试验危机的五种策略:
为应对COVID-19下社交距离所带来的临床试验安全挑战,行业已迅速转向远程解决方案。例如,Parexel公司就在探索远程访问源文档的新方法,研究人员尝试通过电话或视频等远程方式与患者互动。如果患者无法到达现场,其将直接向患者发送临床试验材料(包括可能情况下的研究药物)。
当然,虽然患者的安全可以远程保护,但解决方案需要根据试验的患者群体、方案和地理位置等因素进行定制。
此外,如果研究员不能按照方案进行研究,或完全信任地监测患者安全,他们将需要暂停研究、停止注册或中止参与者。这时,则可将站点精力集中在已经入组研究的患者的安全性上,并保持治疗的连续性。
这是一个高度精细的过程。对每个国家的每个试验中的每个患者的每个问题进行评估,需要高度注意细节,更需要深厚的专业知识,同时也会增加开支。对于在COVID-19大流行中出现的新风险评估问题,几乎没有通用的答案,但在大多数临床试验中,甚至在一些设计复杂的试验中,有一些变通方法是有效的。
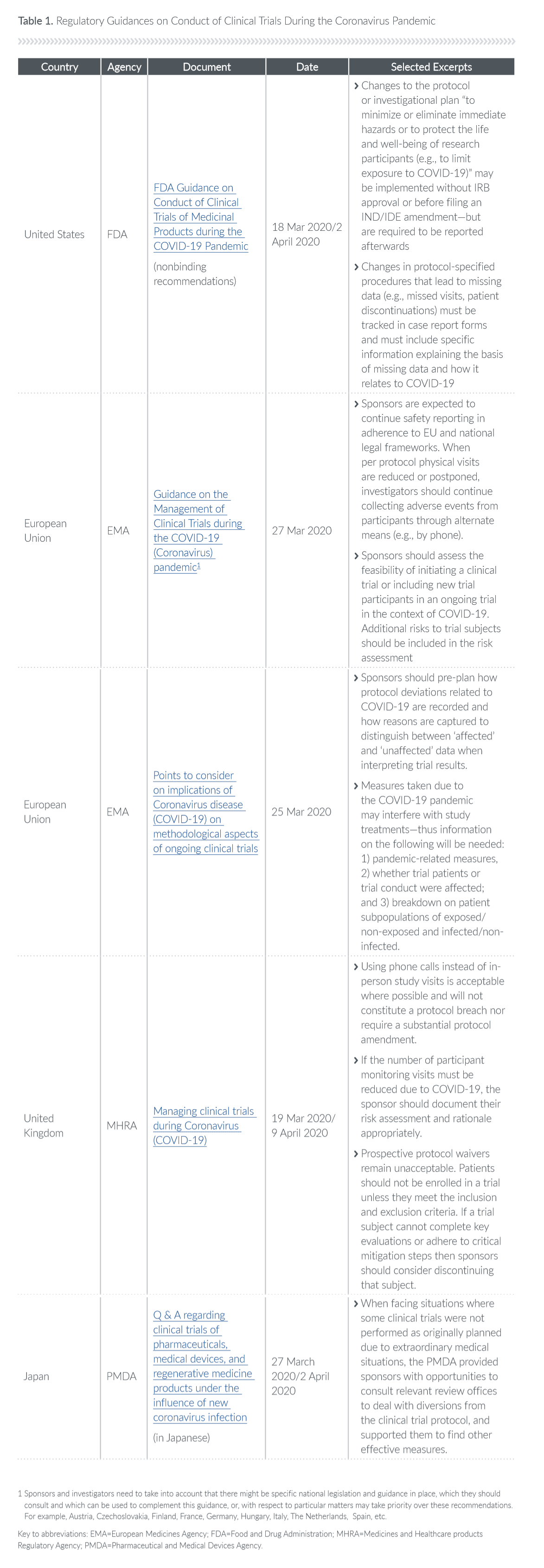
最近欧盟关于COVID-19的指导文件(具体见文末表格)就要求每个试验的发起人,执行COVID-19驱动的利益风险评估和风险缓解措施,其中利益风险评估应包括:
COVID-19大流行对参与者造成的额外风险,以及采取的风险缓解措施;
如何将参与试验的风险(COVID-19中的因素)与参与者和社会的预期收益进行权衡。如果这两种情况冲突,始终以主体安全为准;
将相关方的输入(例如,医学监护人的输入)持续记录在案,优先考虑临床试验中的关键任务以及如何最好地执行这些任务;
为正在进行的临床试验积累专业知识并找到进行全面风险评估的带宽,应该是当今试验发起人的首要任务。
如今,开发COVID-19疫苗和治疗药物已成为全球优先事项。FDA正在优先考虑COVID-19相关产品的提交,为了实现这一目标,他们正在从不太繁忙的地区重新部署员工,或者重新调配有COVID-19处理经验的人员。尽管目前重新部署并未造成审查活动的延迟,但拖延仍然是一种现实的可能性。
在欧盟,面对面的会议已不再普遍,通过电话和邮件与监管机构互动并征求其意见变得越来越重要。然而,数据的电子传输并没有被广泛接受:在一些欧洲国家是可能的,而在另一些欧洲国家则不可能。
在执行之前与监管机构进行讨论是关键。FDA在一系列问题上表现出了显著的灵活性,从项目方如何记录知情同意书,到虚拟地进行临床试验,再到营销提交中使用真实世界的证据。如果一个史无前例的解决方案能够满足监管部门的要求,以及患者和项目方的需求,那么监管机构可能会比过去更加开放。
尽管监管机构永远不会在患者安全性或GCP兼容数据的有效性方面做出妥协,但现在在如何和何时收集数据(例如,可以延迟终点)、如何进行研究监测以及如何将研究药物输送给患者等方面有了灵活性。监管机构需要了解发起人可能想要尝试的任何解决方案,企业可以通过有效沟通来保护其药物开发计划。
世界各地的监管都机构表示,它们将比过去更加灵活。例如,上述FDA指南规定,对方案或研究计划的更改旨在“尽量减少、消除直接危害,或保护研究参与者的生命福祉(例如限制暴露于COVID-19)。“可在未经IRB批准或提交IND/IDE修正案之前实施,但以后必须再报告。”
认识到大流行造成的破坏可能导致丢失数据的增加,FDA要求在病例报告表中必须追踪失访患者停药以及方案指定程序的类似变化,并且必须包括解释缺失数据与COVID-19大流行的关系的具体信息。
EMA(欧盟管理局)鼓励项目方“预先计划”如何记录与COVID-19相关的方案偏差以及捕获丢失数据的原因,以便在解释试验结果时区分“受影响”和“未受影响”数据。虽然EMA已经发布了欧盟的总体指导意见,但欧盟成员国的国家监管机构直接负责这些试验,因此,试验发起人需要检查特定国家的指导文件。
在COVID-19大流行消退之前,大量临床试验(尽管不是全部)将不可避免地暂停,但项目方应继续参与。这方面,Parexel公司目前正在为客户提供大量的监管服务,当客户暂停的试验恢复时,他们将获得所有的信息。
总之,跟踪监管指导和评估不同机构的灵活性,将是在当下暂时中断的药物开发环境中生存的关键。
在文章的最后,作者认为,这场突发公共卫生事件或将永远改变临床试验。当下,行业和监管机构都在努力探索临床试验的新方法,对那些大流行中“更虚拟、更分散”的试验方式进行评估。如果这些新的途径在大流行期间被证明是有效的,那么监管当局今后可能会继续沿用。
不久将来,当新型冠状病毒已成为历史,但在这次大流行中以虚拟试验和混合试验将为典型的研究设计,或将会更好造福患者。


文章评论(0)