腾盛博药正式登陆港交所
“我在这个(乙肝)领域里待了很长的时间,更多经验是知道哪些东西不会成功。没有人能预测哪些东西会成功,因为这需要实验来证明。但知道哪些东西不会成功,就不用去浪费时间和资源,这也算是成功的一半。把失败的东西少做点,成功可能性就会大大提高。”
——洪志博士
腾盛博药于2018年初成立,是一家总部位于中国及美国,并专注于以传染性疾病为代表的公共卫生疾病的生物技术公司,创始人兼首席执行官为洪志博士。目前,通过内部药物研发与授权引进相结合的业务模式,腾盛博药已拥有超10款创新候选产品,涵盖临床前到临床阶段的项目。
此次IPO后,港股迎来了继歌礼之后的第2家传染病领域上市企业。
“过去十年来,人们以前所未有的速度进行创新药物研发,许多危及生命的疾病得到治愈,这些创新对人类健康产生了深远影响。”洪志博士表示,“为中国患者提供创新药物不仅是商机,更是显著改善公众健康的契机。中国病患需要更快、更实惠的渠道获取创新药物和疗法。”
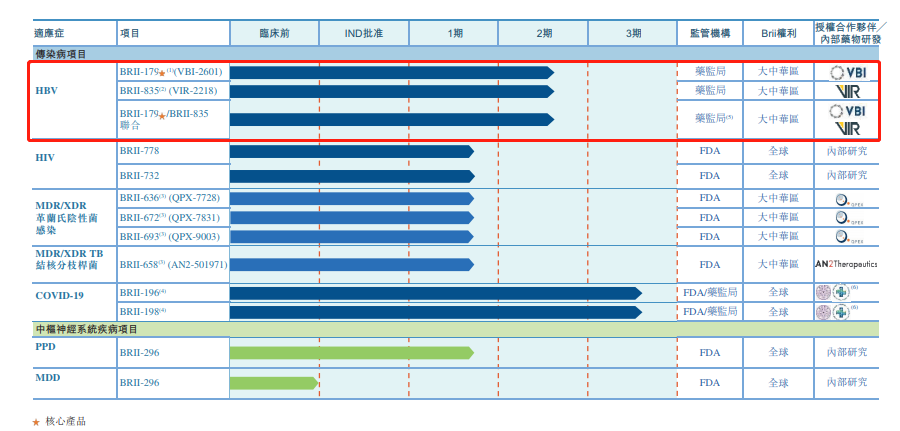
据了解,成立仅3年时间,腾盛博药已建立一条针对传染病及中枢神经系统(CNS)疾病的十多个创新候选产品组成的研发管线,且2款产品已进入Ⅲ期临床。
当然,这离不开其堪称豪华的管理团队。据媒体报道,此前洪志博士曾表示,高管团队中的每个人都有实力单独出去创立一家生物创新药企,也都会是资本追逐的对象,而这种说法似乎并不夸张。
招股书显示,腾盛博药的高管团队具有多元化的专业背景,且主持研发过全球年销售数十亿美元的重磅级产品。创始人洪志博士是全球传染病领域领军人物之一,在创立腾盛博药前,曾就职于葛兰素史克(GSK)、ViiV、Ardea、Valeant等制药公司,拥有超25年的生物制药行业经验。曾在葛兰素史克(GSK)担任全球传染病新药研发高级副总裁及GSK附属公司ViiV的董事,负责监督HIV治疗和预防疗法的研发工作,艾滋病注射治疗药物Cabenuva就是在他的带领下首次获得批准;在Ardea(现阿斯利康)担任副总裁兼首席科学官,负责传染病及肿瘤学的研究和开发;在Valeant担任副总裁兼研究主管,负责传染病、肿瘤学及神经科学的研究和开发。
总裁兼大中华区总经理罗永庆是外科医生出身,曾就职于包括罗氏、诺华、吉利德在内的跨国公司,拥有超过25年的跨国公司工作经验,在抗感染领域也有多年的工作经验,且在吉利德任职期间,罗永庆及其团队共将8款创新药产品引入中国,目前5款产品已进入国家医保目录。
首席医学官严立博士曾担任GSK肿瘤领域副总裁和临床研发负责人,统领GSK肿瘤药物全球研发工作;药物化学研究部门负责人徐连红博士是吉利德重磅产品丙肝治愈药物Harvoni及抗艾滋病复合药物Stribild、Genvoya药物成分的共同发明人;生物制药部分负责人朱青博士则是诺贝尔生理学或医学奖获得者迈克尔霍顿团队成员,拥有超10年的抗感染病及疫苗研发经验。
差异化的定位及产品,加之豪华的创业团队,这也是腾盛博药备受业内和资本瞩目的重要原因之一。IPO之前,腾盛博药已顺利完成3轮融资,共募集资金5.87亿美元。
截图自腾盛博药招股书
其中,BRII-179是从VBI Vaccines引进的一款治疗性疫苗,与目前已上市的第三代HBV预防性疫苗Sci-B-Vac相同,均包含PreS1,PreS2、S 在内的3种HBV表面抗原,但BRII-179通过采用不同的铝佐剂,可诱导建立并维持免疫控制的HBV特异性B细胞及T细胞免疫反应。
临床数据显示,BRII-179在77%的患者中诱导和/或增强了病毒特异性,产生IFN-γ的T细胞的产生,且在44%的患者中诱导针对乙肝病毒的抗体应答。此外,与GSK的Engerix-B相比,BRII-179具有更好的血清保护率。腾盛博药表示BRII-179预计最快于2024年递交NDA。
BRII-835则是一款从Vir Biotechnology引进的siRNA药物,可抑制包括乙型肝炎表面抗原(HBsAg)在内的所有HBV蛋白的表达水平,有助于恢复患者自身针对乙型肝炎病毒感染的免疫应答。且与传统药物相比,siRNA可作用于RNA,因此具有更高的特异性。
由于BRII-179与BRII-835的作用机理相互补充,因此BRII-179与BRII-835联合使用或可打破免疫耐受性,有望实现对HBV的功能性治愈。目前该联合疗法正在中国、香港、新西兰、澳大利亚、泰国和韩国完成BRII-179的Ib/IIa期临床研究,并预计在今年第二、三季度进行国际多中心临床试验(MRCT)研究。此外,BRII-835的II期临床研究也正在国内展开。
2款HIV自研产品中,BRII-778为一种缓释非核苷逆转录酶抑制剂(NNRTI),是Edurant的延长释放制剂,可为患者提供长效NRTI及有效的NRTTI活性。BRII-732是一种可代谢成EFdA的新分子实体,可同时实现核苷逆转录酶抑制剂(NRTI)和有效的HIV逆转录酶易位抑制剂(NRTTI)的功能。
因此,BRII-778/BRII-732联合疗法可提供NNRTI、NRTI、NRTTI 3种作用机理,并能通过延长释放有望实现每周口服一次给药的治疗效果。
BRII-196和BRII-198是2款针对COVID-19治疗的自研产品,且均为从新型冠状病毒感染康复患者体内分离出的人源性单克隆抗体。体外研究表明,BRII-196能完全阻断病毒进入,中和新型冠状病毒的感染活性。而BRII-198则与Spike蛋白上的不同表位结合,并可与BRII-196联合使用增强效果,有可能成为对抗新型冠状病毒大流行的有效疗法。
该项目由美国国立卫生研究院(NIH)下属的国家过敏和传染病研究所(NIAID)主导,目前处于临床Ⅲ期,预计2022年下半年达到商业化。
从整个传染性疾病来看,现在的新冠疫情无疑驱动了科学创新和临床关注,这也让诸如腾盛博药等公司备受关注。不过,今日,腾盛博药开盘即破发,虽有点让人意外,但又似乎在情理之中。
众所周知,同为深耕传染病领域的港交所上市企业,歌礼制药自IPO以来一直股价低迷,这难免让投资者担心,腾盛博药未来的发展无疑充满了挑战。
根据弗若斯特沙利文的资料显示,预计中国传染病药物市场将从2019年的326亿美元增长到2034年的582亿美元(不包括疫苗),且到2034年,中国的HBV和HIV药物市场可达453亿美元,占传染病市场的78.0%。
腾盛博药作为国内布局传染病领域为数不多的药企,除了管线突出外,还拥有专业的研发团队,并在传染病领域、商业化等方面具有丰富的经验,此外采用中美双中心,双总部的运作模式,有机会走出一条自己的路。
祝贺腾盛博药成功上市,也期待其接下来的表现。


文章评论(0)