2023年6月21日,浙江霍德生物工程有限公司(以下简称“霍德生物”)自主研发针对缺血性脑卒中偏瘫后遗症的iPSC来源细胞药物产品hNPC01注射液(受理号:CXSL2300229)获得中国国家药品监督管理局药品审评中心(CDE)的临床试验默示许可。
hNPC01细胞注射液是全球首个IND申报获批的多能干细胞衍生前脑神经前体细胞产品,也是中国首个获得CDE临床默许的神经类iPSC细胞产品。霍德生物创始人、CEO范靖博士表示,“通过颅内给药的iPSC衍生通用型神经细胞治疗产品具有很高的申报挑战,我们很高兴公司的首款iPSC衍生细胞产品(hNPC01)临床试验申请顺利获得了CDE的临床默示许可!非常期待在即将开展的临床研究中充分探索该产品的安全性和有效性!感谢公司团队为此付出多年的努力,也感谢所有股东、患者和行业伙伴的长期支持!霍德生物将继续秉持“患者第一”和“厚积薄发”的理念,通过开发更多高质量的细胞治疗产品与开展严谨合规的临床研究及临床试验验证产品的安全性与有效性,以期可以早日惠及更多患者!”
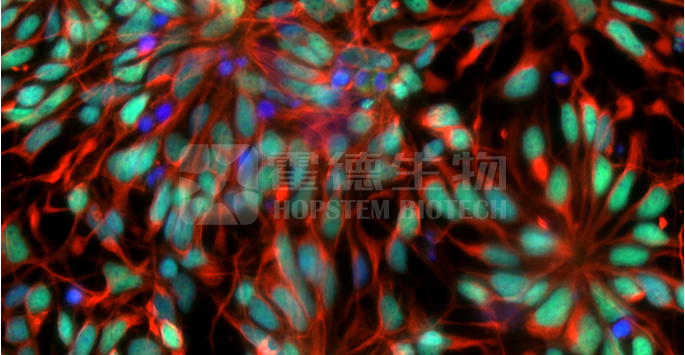
霍德生物通过自主知识产权的iPSC重编程技术所建立的GMP iPSC细胞株,可用于中美及全球临床申报和境内外授权及商用。hNPC01产品是通过霍德生物特有的第二代神经分化专利技术(RONA2.0)由该GMP iPSC细胞株工作库分化而来的临床级人前脑神经前体细胞,可以在颅内移植至啮齿/非人灵长类动物脑梗塞模型的损伤脑实质后长时间存活,并能分化为多种皮层功能神经元和胶质细胞,组成和功能成熟度与人类大脑皮层高度相似,形成新的神经环路和促进功能修复。hNPC01除可针对脑卒中、颅脑损伤等神经损伤疾病的后遗症以外,霍德生物也即将通过适应症拓展探索其可针对的前脑相关的神经退行性疾病和其他疾病。
目前已有的脑卒中(中风)药物主要针对急性期,而偏瘫后遗症一直没有有效的治疗手段。hNPC01在非人灵长类重度脑梗塞模型的双盲药效试验中显示,在脑梗15天后接受hNPC01细胞移植的动物可以达到显著的比对照组动物更快和更好的功能恢复,且在大量的体内外研究(包括长达1年的成瘤、致瘤性研究)中未发现任何产品相关的毒性反应或成瘤性。该产品临床I期为改善缺血性脑卒中偏瘫后遗症的剂量递增、单中心、开放标签的安全性和耐受性的临床研究,将入组缺血性脑卒中急性发病后的6~60个月,并且伴有一侧肢体运动功能障碍的患者。
此次获得CDE临床默许的hNPC01注射液是霍德生物自主研发的国内首款iPSC衍生前脑神经前体细胞产品,也将是全球首个进行美国IND申报的该类细胞产品。目前国际上,hNPC01同类产品仅有斯坦福大学的Gary Steinberg医生主导的iPSC衍生前脑神经前体细胞治疗脑梗塞后遗症的临床研究。该项目由NIH和斯坦福大学等提供资金支持并在2022年4月启动了临床研究。

文章评论(0)