第二家赴美上市的中国CAR-T公司,要改变行业的“游戏规则”?
日前,亘喜生物(GRACELL BIOTECHNOLOGIES INC.)正式向美国证监会递交了招股书,拟在纳斯达克上市,股票代码为“GRCL”。本次上市发行由花旗、杰富瑞、长桥证券、富国证券担任联席主承销商,拟募资规模为1亿美元,用于支持亘喜生物主要候选药物及早期候选产品的开发,扩大其在中国生产设施的建设和美国研发中心的建立等。
对于亘喜生物来说,此番冲刺纳斯达克可谓是有备而来。而一旦上市成功,其也将成为继传奇生物之后,第二家在美股上市的中国CAR-T企业。
据公开资料,曹卫博士拥有30多年生物技术研发经验,早年担任过哈佛和斯坦福医学院研究员,并曾在美国凯龙(诺华制药和拜耳)和美国昂飞(赛默飞世尔科技)担任高级科学管理职务。值得一提的是,曹卫还曾以联合创始人的身份加入细胞治疗公司西比曼,并于2015年成功带领西比曼生物登录纳斯纳克。
这之后,曹卫又离开西比曼开始了投资生涯。按照曹卫的说法,在投资过程中,他遍览全球各类CAR-T项目,看到了一些不错的技术,但也看到一些普遍存在的问题。“大部分公开发表的CAR-T技术,是想要克服某个技术问题,或者提高某个技术特性,比较少从解决行业共性挑战、克服产品的核心困难来考虑问题。”曹卫曾在接受研发客的采访时如此谈到。
在曹卫的观察中,CAR-T行业普遍存在着成本高、制备周期长、缺乏即用型产品、对实体瘤效果不好等痛点。而瓶颈就是机会,曹卫的二次创业由此开端,这些行业普遍存在的痛点也就成为了亘喜生物产品开发的主要方向。
以“高成本”这一痛点为例,目前已上市的两款CAR-T产品价格高达四十万美元左右,这样的高价是整个行业都面临的挑战,但却很难有解决办法。曹卫曾提到,有专家在国际大会上提到,私下也表达过一个意思:“谁要是能够把成本降一半,这就是行业的game changer(游戏规则改变者)。”
“就亘喜生物目前的潜在产品来说,成本降低绝对不止一半,可能降低好几倍,这就是game changer。”曹卫曾在接受媒体采访时透露表示。在他看来,亘喜所带来的创新技术虽然不能叫“革命”,但可以说做到了“改变游戏规则”。
此外,通过翻阅资料可以看出,“想要打破常规,要靠技术革新”这一思路则贯穿曹卫创业的始终。如在此前的一次访谈中,曹卫就谈到目前新入场的 “me-too” CAR-T 公司越来越少,大家或多或少都有一些小创新,但创新的步伐不大。他认为,能从这个赛道里跑出来的公司一定是有超强创新能力,给这个行业带来巨大变化的公司。
回到前文提到的问题,亘喜生物手里握着的到底是什么?
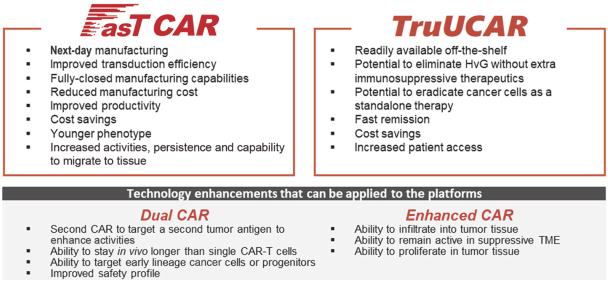
具体来说, 从“周期长、成本高、缺乏即用型产品、对实体瘤效果不好”这四大痛点问题出发,目前亘喜生物已开发了FasTCAR 、TruUCARTM、Dual CAR和Enhanced CAR 四大核心技术,并以此为基础开发了系列潜在研发管线,覆盖白血病、淋巴瘤、骨髓瘤和实体瘤等疾病。
资料来源:亘喜生物招股书
一般传统的CAR-T制备流程包括T细胞的分离、激活、转染、扩增等,而亘喜生物搭建的FasT CAR技术平台可快速制备同时激活与转染,而没有扩增过程,因而将制备周期压缩到24小时以内。也就是说,基于该平台将更有可能开发出表型更年轻、耗竭更少、杀伤更佳的自体CAR-T细胞产品。
TruUCAR为通用型CAR-T技术,旨在产生高质量的同种异体CAR-T细胞疗法。同时,由于其临床使用时无需桥接骨髓干细胞移植,所以基于TruUCAR平台所开发的“即用型”同种异体CAR-T细胞产品,将呈现出更低的成本和更高的方便性。
Dual CAR和Enhanced CAR则可与FasTCAR 和 TruUCAR一起使用,进一步增强CAR-T的治疗效果。其中Dual CAR技术则主要针对治疗后复发的问题, Enhanced CAR则对特定基因进行编辑,赋予免疫细胞治疗实体瘤的能力。
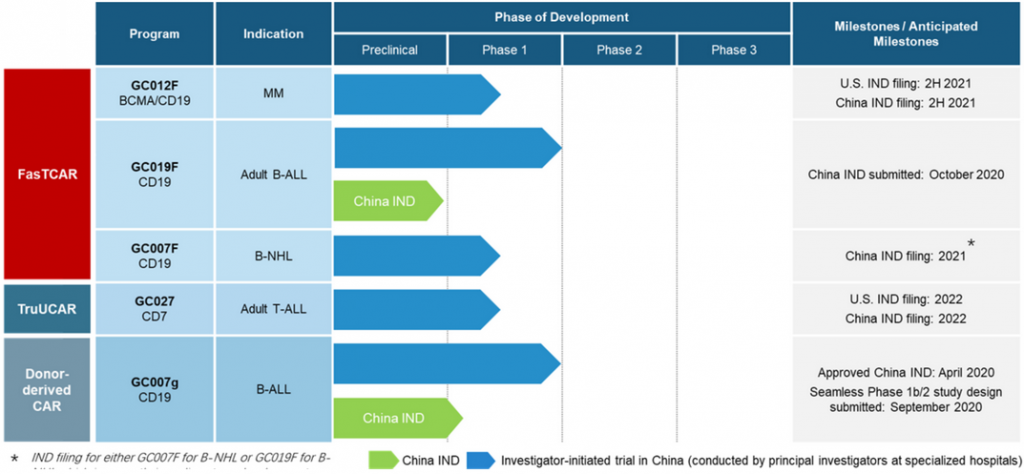
基于以上技术平台优势,亘喜生物目前已搭建了一系列自体和异体细胞疗法候选药物,其中5款候选产品进入临床阶段,不过这些产品目前仍在临床 Ⅰ 期。此外从靶点的选择来看,亘喜生物的这5款潜在产品除了靶向BCMA/CD19的双特异性CAR-T和靶向CD73的 CAR-T外,另外3款则都聚焦于当下大热的靶点CD19。
资料来源:亘喜生物官网
GC012F
GC012F是亘喜生物基于FasTCAR平台技术开发的靶向BCMA/CD19双抗原的自体CAR-T疗法,用于治疗复发性或难治性多发性骨髓瘤 (r/r MM)。目前,该产品正在中国进行 Ⅰ 期临床试验。
12月6日,在2020年美国血液病学会(ASH) 年会上,亘喜生物发布了GC012F 治疗16例r/r MM患者的首次人体试验数据。结果显示,早期总响应率(ORR)达93.7%,所有响应均达到或超出很好的部分响应(VGPR),显示出快速深入且持久的响应特点。
GC027
这是基于TruUCAR平台开发的同种异体候选产品,则用于治疗复发性或难治性T细胞急性淋巴细胞白血病 (r/r T-ALL)。该产品目前在国内进行 Ⅰ 期临床试验,预计在2022年向FDA和NMPA提交相关适应症的IND申请。
2020年4月底,在美国癌症研究协会(AACR)年会中,亘喜生物报告了GC027的一项 Ⅰ 期临床试验数据,旨在验证其治疗r/r T-ALL患者的可行性。结果显示,5名(100%)受试者获得完全缓解,不过5名受试者也均出现严重的细胞因子释放综合征,该毒性被归因于使用了相对高剂量的Car-T细胞。
GC007g
这是亘喜生物的首个进入临床的候选产品,源于健康供者T细胞的同种异体T细胞疗法,目前该产品同样处于 Ⅰ 期临床试验中。2020年4月,GC007g成为国内首个获得临床批件的异体CAR-T产品,用于治疗异基因移植后复发难治性CD19阳性急性B淋巴细胞白血病(B-ALL)。
GC019F
一款基于FasTCAR平台开发的靶向CD19的自体CAR-T候选产品,用于治疗成人B细胞急性淋巴细胞白血病(B-ALL),已于2020年10月向CDE提交IND申请并获受理,预计将于2020年底开始患者招募。
GC007F
同样是基于Fastcar平台研发的靶向CD19的自体CAR-T候选产品,用于治疗B细胞非霍奇金淋巴瘤(B-NHL),计划在2021年向NMPA提交IND申请。
对于产品研发进度,此前曹卫曾表示,“目前亘喜生物成立仅3年多时间,接下来预计快则两年慢则三年,公司第一个产品(符合老百姓承受力)可以上市。”而就当下来说,曹卫表示目前有很多企业对FastCAR和TruUCAR GC027感兴趣,有可能通过合作产生现金收入。
总得来说,在目前业界和资本市场对CAR-T行业固有的瓶颈和前景表现出一定担忧的背景下,亘喜生物基于独具特色的核心技术,在CAR-T 产品在制备周期和成本上具备非常明显的优势。
但在另一方面,无论是从整个行业的发展现状,还是从亘喜生物自身的研发进度来看,CAR-T细胞疗法依旧是一块“难啃的骨头”。当然,即使不会那么容易,但这个事情总得有人去做。
期待接下来,亘喜生物不管在研发还是资本市场上,都能有新的突破。



文章评论(0)