环肽再掀浪潮:Argenx豪掷15亿美元,撬动“不可成药”靶点
根据公告内容,此次合作将依托UNP的AI驱动合成环肽发现平台,针对Argenx所指定的一系列尚未披露的“不可成药”靶点,设计并筛选出具备高效力、高选择性、且具有口服潜力的候选环肽药物。
UNP将负责从靶点到候选分子的前期发现流程,包括分子设计、合成、筛选和体内外验证,直至临床前开发门槛。Argenx则拥有选定资产、启动临床试验并主导商业化的后续推进权。
尽管协议未披露具体的首付款金额与阶段性资金支持细节,但交易总额高达15亿美元,涵盖研究、开发、监管和商业化各阶段的里程碑付款,以及Argenx行使选择权时的附加支付。此外,UNP还将获得潜在产品上市后的销售分成,Argenx也将对其进行股权投资,体现出双方在战略与资本层面的深度捆绑。
这一合作是迄今为止环肽领域金额最大的交易之一,充分说明Argenx对该技术模态商业化前景的高度认可。
作为此次交易的技术核心方,UNP是全球首批实现合成环肽规模化、工程化、智能化开发的平台型企业之一。
- 其平台整合了AI建模与药效预测、并行合成(parallel synthesis)与头尾环化工艺;
- 引入“direct-to-biology”策略,实现合成环节与生物筛选的快速联动;
- 强调环肽分子的药物化特性设计(如细胞穿透、稳定性、口服可及性);
- 核心团队源自加州大学、Scripps等科研机构,在天然产物合成与机器学习方面具备领先经验。
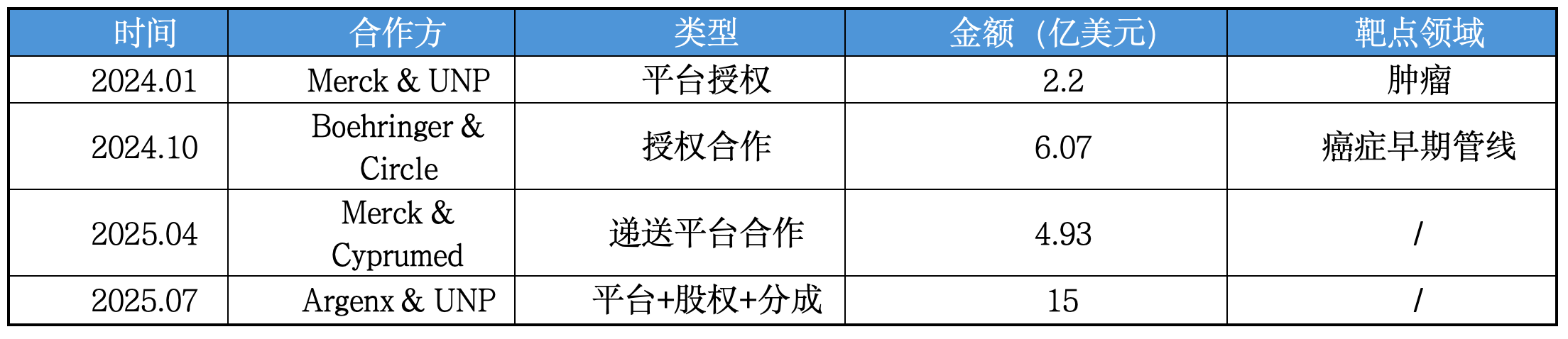
UNP曾在2024年初与默沙东达成一项金额达2.2亿美元的合作,用于开发肿瘤领域的挑战性靶点。此次与Argenx的合作金额则显著提高,合作深度也更广。
Argenx在全球免疫学创新药领域已有成功经验,其核心产品Vyvgart(依维莫单抗)已在多国获批,用于治疗重症肌无力,并正在拓展至CIDP等多个适应症。
此次联手UNP,是其“后Vyvgart时代”全球布局的重要战略动作:
- 在靶点层面,从FcRn等抗体靶向机制向细胞内、蛋白互作等“结构难度高”的空间进发;
- 在模态层面,从单一抗体机制拓展至新型小分子-大分子之间的环肽中间模态;
- 在研发结构上,采用外部平台+内部推进的组合模型,提高新靶点开发速度;
- 在资本结构上,使用“平台授权+股权投资+销售分成”的组合结构,实现风险分担与协同共赢。
- 化学合成复杂,尤其是头尾闭环与空间构象控制;
- 稳定性与口服生物利用度难以兼顾;
- 高通量筛选流程尚未形成产业标准;
- CMC开发与杂质谱控制要求高;
而UNP的平台则正是瞄准这些环节的系统化解决方案,成为各大药企投资的关键理由。Merck将其称为“Goldilocks模态”,即结构大小刚好、可设计性强、结合力与穿透性兼备的新化学类别。
Argenx这笔交易并非孤例,而是整个环肽产业趋势的一部分。近两年,环肽领域的代表性交易还包括表1中的案例。
表1. 近期环肽交易(不完全统计)
其中Argenx的交易金额最高,覆盖要素最全,显示出该领域平台属性的进一步成熟与行业内对其价值的重估。
随着生物医药研发步入深水区,传统药物模态面临多重困境——小分子药物虽具备良好的口服性和组织渗透性,但难以靶向复杂蛋白互作(protein–protein interactions, PPIs);而抗体等大分子虽在特异性上表现优异,却受限于递送方式和细胞内靶点难以覆盖。如何在两者之间寻找一种既具有结构复杂性、又具备“药物样性”的中间模态,成为新药开发的一大命题。
环肽正是在这一结构空隙中异军突起的关键模态。其闭环结构赋予其以下独特优势:
- 结构刚性 + 构象可控:环肽天然具备空间构象限制,能够在与目标蛋白结合时提供更高的亲和力和选择性,同时避免非特异性相互作用所导致的毒性问题。
- 可靶向“不可成药”靶点:许多蛋白互作面是扁平、宽广、无明显小分子结合口袋的结构,环肽因其分子大小介于小分子与抗体之间,能够更好地结合这类界面,实现对传统手段无法靶向区域的结合。
- 模拟天然产物,设计更灵活:自然界中已有众多环肽类活性物质(如环孢素、万古霉素等),为合成环肽提供了丰富的先导模板。如今的AI辅助设计与构象建模技术更使其在分子级别得以理性优化。
- 模态平衡:兼具“抗体+小分子”的优点:与抗体相比,环肽具备更小分子量、更低免疫原性、更高穿透能力;与小分子相比,环肽结构复杂性高,可实现更广的结合界面、更强的结合亲和力。通过修饰(如脂化、糖基化、PEG化等)及口服递送系统优化,环肽分子越来越具备临床所需的代谢稳定性、体内半衰期与组织分布特征。
多重因素促成了环肽模态从实验室走向产业化:
- 技术平台:AI驱动合成、并行化学、多维生物筛选的系统集成;
- 成本因素:自动化合成与筛选平台大幅降低环肽研发成本;
- 投资热潮:Argenx、Merck、Boehringer 等巨头连续出手环肽平台;
- 临床先例:如MK-0616(默沙东)等药物进入III期,提供可商业化前景;
环肽的兴起不是偶然,它不只是一个“补位者”,更可能成为新药发现下一个十年的主流模态之一,特别是在复杂疾病(癌症、自免、感染、罕见病)与结构挑战性靶点(如PPI、转录因子、核内通路)中,展现出不可替代的潜力。
参考资料:
Waldron, J. Argenx sings $1.5B pact to turn Unnatural Products’ macrocyclic peptides to “undruggable” targets. Fierce Biotech. 01. 07. 2025.
Waldron, J. Merck & Co. signs $220M macrocyclic peptide deal after hailing “next wave of drug discovery”. Fierce Biotech. 23. 01. 2024.



文章评论(0)