PD-1医保谈判前夜,聊聊2020年新获批的这几个适应症
日前,根据中国国家药品监督管理局(NMPA)官网发布的通知,默沙东PD-1抑制剂Keytruda(简称“K药”)已获批用于肿瘤表达PD-L1的转移性或不可切除的复发性头颈部鳞状细胞癌(HNSCC)患者的一线单药治疗。这是K药在中国市场获批的第6个适应症,同时也标志者国内一线头颈癌进入免疫治疗时代。
实际上,这也是进入2020年以来,PD-1抑制剂在中国市场第7次获批上市新适应症(下图标红部分)。加上此前6款国内上市PD-1的10次适应症获批,目前中国市场PD-1抑制剂已累计获得了17次新适应症的获批。
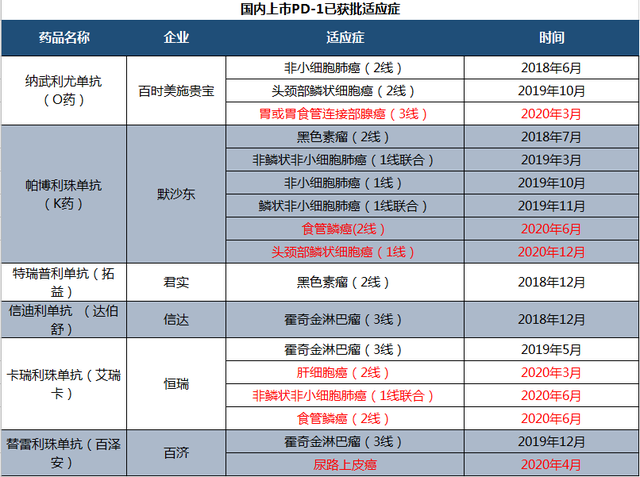
(国内上市PD-1已获批适应症汇总,红色部份为2020年新获批适应症)
值得一提的是,当下正值医保谈判之际,而明日即将正式“开谈”的5款PD-1产品(信迪利单抗除外)可谓备受关注,今天恒瑞、信达、君实、百济四家本土PD-1药企更是股价全线大涨,其中信达盘中涨幅高达9%,恒瑞涨幅也近8%。
从适应症的角度来看,目前K药和O药在中国市场一直在发力肺癌、胃癌、食管癌、头颈鳞癌等大癌种,且K药在2020年凭借6大适应症一举成为中国市场获批适应症最多的品种。4款本土PD-1中,虽然恒瑞的卡瑞利珠单抗和百济的替雷利珠单抗上市较晚,但在2020年,这两款产品势头强劲,尤其卡瑞利珠单抗更是一年之中拿下了3个大癌种的适应症。
医保谈判前夜,在各PD-1企业围绕适应症展开激烈角逐之前,以下我们重点梳理了2020年以来PD-1抑制剂在国内市场新获批适应症具体情况。
头颈部鳞状细胞癌
K药(默沙东)
获批时间:2020年12月
K药这一适应症在2020年5月1日获得NMPA受理,并于7月底被CDE纳入优先审评,12月正式获批上市,中间历经不过短短7个月时间,可谓再次刷新“中国速度”。
头颈癌是一类十分常见的恶性肿瘤,包括唇及口腔癌、口咽癌、下咽癌和喉癌等癌种,其中90%的患者为鳞状细胞癌,而在头颈部鳞癌患者中,约50%会出现复发且多发生于2年内,对于一线治疗失败的复发性或转移性患者,其五年生存率仅3.6%。
在今年9月份举行的ESMO年会上,一项名为KEYNOTE-048的研究展示了K药在头颈部鳞癌中的临床数据,结果显示在PD-L1表达阳性(CPS≥20)患者中,对比EXTREME方案(化疗+EGFR靶向药),K药将中位总生存期从10.8个月延长到14.9个月,降低了39%的疾病死亡风险,4年生存率近乎3倍;客观缓解率虽稍低,但中位持续缓解时间超5倍;不良反应发生率大幅下降,3级以上不良反应发生率仅为四分之一。
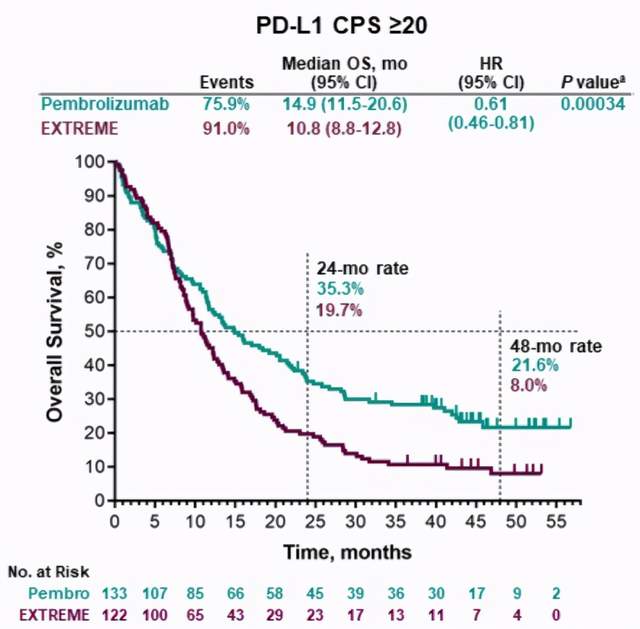
KEYNOTE-048研究数据
此前头颈部鳞癌的标准一线治疗方案,是EGFR靶向药西妥昔单抗联合铂类化疗和5-FU(EXTREME方案),该疗法早在2008年就获得美国FDA批准,但直到今年3月份其才在国内获批。而此次K药适应症获批则意味着国内r/m HNSCC从靶向治疗进入到免疫治疗时代。
食管鳞癌
K药(默沙东)
获批时间:2020年6月
2020年6月19日,K药在国内的第五个适应症获批:用于治疗PD-L1阳性(综合阳性评分CPS≥10)、既往一线全身治疗失败的局部晚期或转移性食管鳞状细胞癌。这是K药在中国获批的第一个消化领域适应症,也被认为开启了免疫治疗在中国特色消化道肿瘤的新征程。
食管癌是常见的消化道癌种之一。据世界卫生组织国际癌症研究机构的《全球癌症报告》,仅2018年全球就有57.2万人新诊断为食管癌,同时又有50.9万人死于食管癌,而这里面一半以上的新发患者和死亡患者都来自中国。一直以来,食管癌的治疗主要以外科手术为主,并结合辅助放、化疗等综合治疗模式,但现有药物的化疗效果并不佳,不可手术的食管癌五年生存率往往只有15%-20%。
据K药二线治疗食管癌的III期临床试验KEYNOTE-181研究结果显示,在整体PD-L1阳性(CPS≥10)的患者中,K药单药治疗显著优于化疗方案(多西他赛、紫杉醇或伊立替康),中位OS达到9.3个月,而化疗组为6.7个月,死亡风险降低31%;在中国PD-L1阳性食管癌患者中,K药更是将中位OS从5.3个月延长到12个月,疾病死亡风险降低66%。
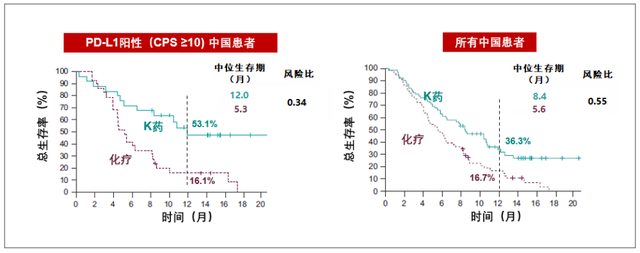
整体来看,K药用于中国高发食管鳞癌的二线治疗要优于目前的化疗方案,可显著延长患者生存期。同时,由于亚洲和欧美食管癌的类型不同(亚洲鳞癌为主,欧美腺癌更常见),中国区的数据一定程度上也要优于整体数据,显示出更清晰的治疗优势。
食管鳞癌
卡瑞利珠单抗(恒瑞医药)
获批时间:2020年6月
同样是在2020年6月19日这一天,恒瑞医药的卡瑞利珠单抗也拿下了两个新的适应症:单药二线治疗晚期食管鳞癌、联合培美曲塞和卡铂一线治疗晚期或转移性非鳞非小细胞肺癌。
到此,卡瑞利珠单抗已拿下4个适应症,而在食管癌领域,这是第一个获批的国产免疫药物。
卡瑞利珠单抗此次食管鳞癌适应症的获批是基于 ESCORT的Ⅲ期临床研究。该研究入组中国患者457人,按1:1的比例随机分配进入卡瑞利珠单抗试验组及化疗组,其中228人接受了卡瑞利珠单抗的治疗,220例患者接受了化疗。结果显示,卡瑞利珠单抗可将患者总生存期从6.2个月延长至8.3个月,降低死亡风险近30%;同时卡瑞利珠单抗组客观缓解率是化疗组的3倍之多(20.2% vs 6.4%),且安全性可控。
值得一提的是,该研究还表明无论PD-L1表达如何,卡瑞利珠单抗相较化疗都可带来显著生存获益。换言之,K药和卡瑞利珠单抗同一时间获批的食管鳞癌二线治疗的适应症,但K药存在“(CPS≥10)”的人群限制,而卡瑞利珠单抗没有。
非鳞状非小细胞肺癌
卡瑞利珠单抗(恒瑞医药)
获批时间:2020年6月
这是卡瑞利珠单抗在今年6月19日这天获批的另一个适应症。它是第一个被批准的肺癌一线治疗国产PD-1抑制剂,更被认为是首个获批肺癌适应症的国产免疫药物。
作为发病率和死亡率位居首位的一大癌种,肺癌无疑是PD-1厂家的必争之地。实际上早在2015年,O药就拿下了NSCLC的二线用药,但后来CheckMate-026试验的失利让它错失了一线治疗的先机,相反K药则凭借KEYNOTE-189试验的成功,率先拿下了NSCLC的一线用药。
在中国市场,K药于2019年3月获批,联合培美曲塞、顺铂用于EGFR和ALK阴性的非鳞NSCLC一线治疗,开启了国内NSCLC肿瘤免疫疗法一线用药的序幕。而继K药之后,加入国内非鳞NSCLC一线治疗之列的,正是卡瑞利珠单抗。
卡瑞利珠单抗的此次获批是基于CameL的研究结果,这是项卡瑞利珠单抗联合卡铂+培美曲塞用于晚期/转移性EGFR/ALK突变阴性非鳞NSCLC一线治疗III期研究。结果显示,卡瑞利珠单抗治疗组的中位无进展生存期(PFS)为11.3个月,而对照组是8.3个月,卡瑞利珠单抗治疗组的疾病进展或死亡风险相对下降了39%;客观缓解率(ORR)方面,卡瑞利珠单抗治疗组为60%,显著优于标准化疗对照组的39.1%。
总得来说,作为首个专门针对中国NSCLC患者的一线免疫联合化疗III期试验,CameL的疗效数据源于中国患者群体,因此卡瑞利珠单抗对于中国患者的获益也更具优势。
尿路上皮癌
替雷利珠单抗(百济神州)
获批时间:2020年4月
2020年4月11日,百济神州替雷利珠单抗正式获NMPA批准用于治疗接受含铂化疗失败包括新辅助或辅助化疗12个月内进展的局部晚期或转移性PD-L1高表达的尿路上皮癌(UC)患者。这是替雷利珠单抗在国内获批的第二个适应症,也是国内首个获批尿路上皮癌适应症的PD-1单抗。
尿路上皮癌主要是目前最常见的膀胱癌类型,占所有膀胱癌病例的90%以上。公开资料显示,膀胱癌已成为全球第10大常见肿瘤,2018年约有55万例新增病例,其中国内约有超过8.2万新增膀胱癌案例,占世界膀胱癌新增案例的15%。
实际自2016年以来,美国FDA已批准5个PD-1/PD-L1单抗用于晚期尿路上皮癌的二线治疗,不过这些药物此前并未在国内获批晚期尿路上皮癌适应证。就国内局部晚期不可手术以及转移性尿路上皮癌患者来说,除铂类基础的化疗外,治疗手段与可选药物非常有限,且患者预后相对较差。
替雷利珠单抗二线治疗尿路上皮癌这一适应症的获批无疑填补了国内这一空白。此次获批基于BGB-A317-204研究,该研究共入组113例既往接受过含铂化疗的PD-L1阳性的局部晚期或转移性尿路上皮癌患者,结果显示在101例可评估患者中,10例患者完全缓解(9.9%),15例患者部分缓解(14.9%),整体ORR达24.8%,DCR达38.6%;治疗过程中大部分治疗相关不良事件≤2级,仅贫血、食欲下降、发热的发生率>15%。
值得一提的是,目前替雷利珠单抗联合化疗用于晚期尿路上皮癌患者一线治疗的III期临床研究也已正在进行中。
胃腺癌和胃食道连接部腺
O药(BMS)
获批时间:2020年3月
2020年3月11日,BMS的PD-1抑制剂纳武利尤单抗注射液(以下简称“O药”)获NMPA批准用于治疗既往接受过两种或两种以上全身性治疗方案的晚期或复发性胃或胃食管连接部腺癌患者。这是O药在中国获批的第三个适应症,也是国内首个获批用于胃癌的免疫肿瘤药物。
胃癌是最常见的消化道肿瘤之一,而我们占了全球发病人数的44%和死亡人数的50%,据2019年癌症报告显示,在中国,胃癌发病率位居恶性肿瘤第二,死亡率位居第三位。目前晚期胃癌的治疗仍以化疗和靶向治疗为主,但往往复发率和转移率很高,总体预后较差,中位生存期难以突破2年。
O药此次获批是基于Ⅲ期临床研究ATTRACTION-2,该研究纳入了493位日本、韩国与中国台湾三地既往至少二线化疗失败或不耐受的晚期胃或胃食管结合部癌患者。结果显示,O药组两年总生存率(OS)为10.6%,安慰剂3.2%,O药组是安慰剂的3倍多;降低38%死亡风险,87%都能活过一年,61.3%可以存活两年以上。
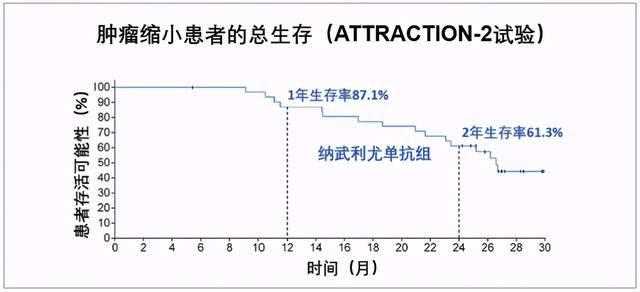
这个研究最大特点之一,就是参与试验的全都是亚洲患者,尤其是中国台湾患者的数据,对中国大陆患者有直接的意义。所以,该研究也被认为首次明确了胃癌免疫治疗在东亚人群中的有效性及安全性,这使得O药成为了首个经Ⅲ期临床研究证实,能为中国晚期胃癌患者带来显著生存获益的PD-1抑制剂。
肝细胞癌
卡瑞利珠单抗(恒瑞医药)
获批时间:2020年3月
2020年3月4日,恒瑞卡瑞利珠单抗获NMPA批准用于接受过索拉非尼治疗和/或含奥沙利铂系统化疗的晚期肝细胞癌患者的治疗。这是卡瑞利珠单抗获批的第二个适应症,也是首个在中国获批的治疗晚期肝癌的PD-1抑制剂。
我国是肝癌第一大国,据统计国内每年超过30万人死于肝癌,占全球肝癌死亡人数的一半左右。但一直以来,我国晚期HCC一线标准治疗药物可选方案仅有索拉非尼、仑伐替尼、含奥沙利铂等系统化疗,总体治疗客观缓解率低,生存获益有限。
卡瑞利珠单抗肝癌适应症的获批是基于一项卡瑞利珠单抗治疗既往系统性治疗失败的中国晚期肝细胞癌的全国多中心II期临床研究结果。该研究共入组220例患者,分别按2周一次和3周一次的给药频率,接受卡瑞利珠单抗单药治疗。试验结果显示,两个治疗组的疗效都相当不错,在主要终点客观缓解率(ORR)上,全部病例的总ORR是14.7%,另一项主要终点6个月生存率则是74.4%。此外,所有患者的12个月生存率为55.9%。
而值得注意的是,该研究入组患者的乙肝感染率、存在肝外转移灶的比例都超过80%,很能代表中国患者特点,这也是目前为止最大规模针对中国晚期肝癌患者的免疫疗法研究。


文章评论(0)