“魔法子弹”ADC,稳扎稳打还是孤注一掷?
有人砸钱有人退场,究竟是蓝海还是红海?如何定位突围,引起业内广泛关注。
作者:马瑞
ADC药物兼具抗体的高特异性和细胞毒素的高抗肿瘤活性,同时因其定向释放的特性,安全性更加可控,是目前肿瘤治疗领域的热点研究方向之一。
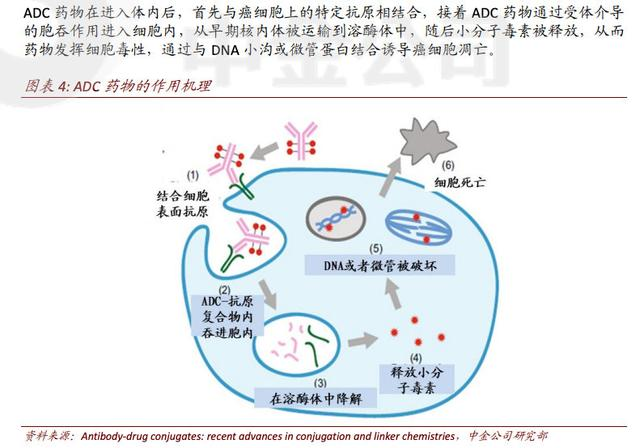
ADC药物的作用机理
来源:中金公司研究部
ADC从1972年首次用于动物实验开始,经历了三代发展历程,构成要素不断迭代,药物治疗窗口不断拓宽。全球ADC临床试验数量也呈稳步提升趋势,2021年全球I期至III期的临床试验数量已达到136个。
第一代的ADC药物以Mylotarg为代表,抗体多采用鼠源或嵌合人源化抗体,连接子不稳定,载药的毒性较低且是随机偶联,因而有效性不高,毒副作用较大。
第二代的ADC药物以Adcetris和Kadcyla为代表,采用人源化抗体、毒性更高的载药,抗体的靶向性也更好,但随机偶联造成的脱靶毒性仍不可忽视。
第三代的ADC药物以DS-8201为代表,完全人源化的抗体、高毒性载药以及定点偶联技术的使用使得疗效更好,但高毒性载药所带来的可能毒副作用仍存在。

不同阶段ADC特性
来源:药融圈
一、ADC技术壁垒更高,未来产品生命周期更好。
- ADC分子包括大分子抗体和小分子毒素两个部分,技术壁垒相较于单抗或者小分子药物更高,所以竞争格局也更好;
- 同时,多样的ADC技术平台有助于做出差异化的产品;
- 从长期来看,优秀产品的生命周期也会更好。
二、ADC的适用人群更广,潜在市场空间广阔。
- 首先已有多个靶点ADC药物显示出了泛癌种治疗的潜力,如靶向HER2ADC药物在乳腺癌、胃癌、结直肠癌、肺癌以及尿路上皮癌等多癌种中疗效优异;
- 其次ADC药物可以通过其Bystander(旁观效应),在肿瘤抗原低表达的患者中起效,进一步扩展适应症人群;
- 最后,虽然现在ADC药物主要聚焦在末线治疗上,但是其也有往前线治疗推进的潜力。
三、在不同的开发阶段,ADC又有不同的关注重点。
- 对于ADC产品的跟踪,对于早期产品,主要关注产品的分子设计与公司技术平台,以及全球同靶点药物的临床进展;
- 对于临床阶段产品,主要关注安全性与疗效结果的披露,以及潜在license-out(对外许可)的可能性。
- ADC药物未来几年有望不断在新靶点,适应症以及安全性和疗效上做出突破,有较大的市场潜力。
通过下列数据依然可以窥见ADC未来市场潜力。
从研发层面来看,截至目前,全球已有14款ADC药物获批上市,且2021年全球销售额突破50亿美元。根据药智数据,全球ADC临床开发项目共471个,靶点主要集中在HER2(38.4%)、EGFR(11.9%)、TROP-2(9.9%)、Claudin18.2(9.9%)少数几个热门靶点上。
从适应症来看,95.17%的管线布局的适应症均是肿瘤,其次是自身免疫性疾病(1.75%)、细菌感染(0.66%)、湿性年龄相关性黄斑变性(0.66%)等。
从研发进度来看,目前绝大多数的研发项目均处于早期阶段。其中临床前占比46.78%,临床I期占比29.93%,临床I/II期占比7%,临床II期占比7.54%。
从资本市场来看,相比于传统疗法,ADC拥有无可比拟的优势,激发了全球的开发热情。为了进入该领域,ADC相关的BD交易无论是数量还是金额都直线上升。
截至2022年2月,中国处于临床前和临床试验中的ADC管线总计153条,占全球ADC管线总数的36.86%。还处于发展初期的中国创新药产业,拥有如此众多的ADC管线。原因有二:
一方面,必然存在跟风和过度投资。目前国内相当一部分在研HER2靶向ADC药物,是以罗氏上市多年的ADC药物T-DM1为蓝本开发,是T-DM1的me too类型产品。这就意味着这部分在研ADC管线还未上市就已经落后,其发展前景不容乐观。此前就已经有某上市公司因临床数据不达预期,砍掉进入临床III期的ADC管线的案例。
另一方面,量变引发质变,在庞大的ADC研发大军中,如果能依靠真正的源头创新、做出有实质临床获益的ADC药物,这部分企业必然将引领中国ADC药物的崛起。
事实上,中国的ADC药物研发公司,确实诞生了一些佼佼者,成功地在国际市场占有一席之地。
国内企业中,荣昌生物、云顶新耀已有ADC产品获批上市;恒瑞医药、东耀药业、科伦药业、信达生物、华东医药的ADC产品已经处于临床III期阶段。荣昌生物自主研发的维迪西妥单抗,已分别于去年6月和12月获国家药监局附条件批准胃癌、尿路上皮癌适应症。目前,已上市的ADC共14款。
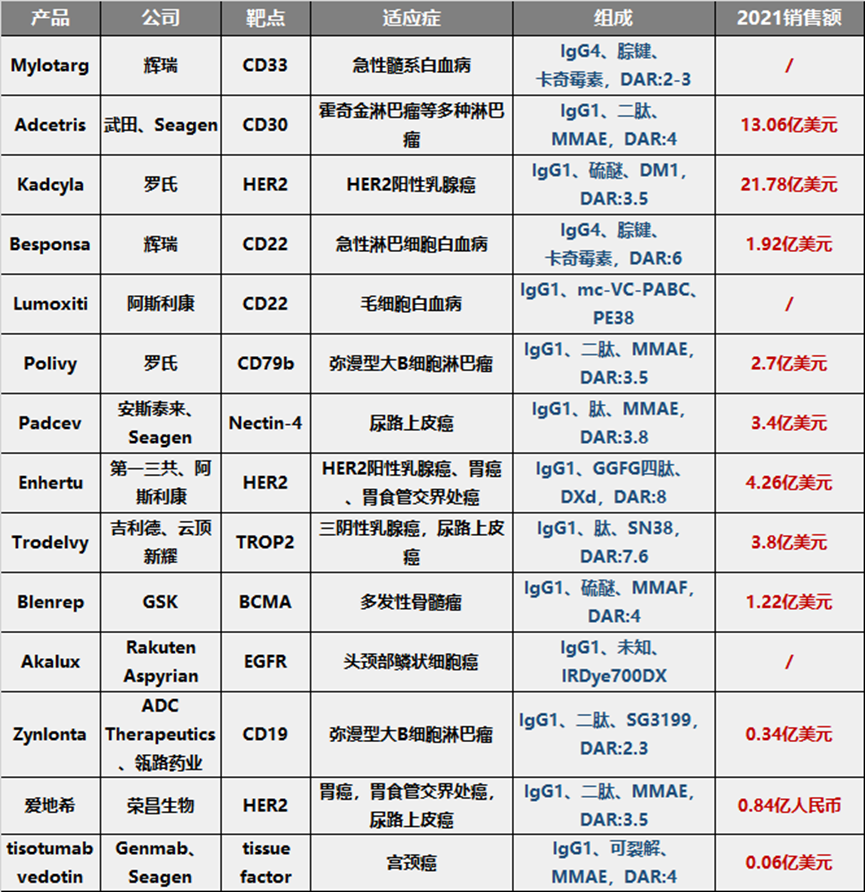
已上市14款ADC
来源:药渡
众所周知,肿瘤的发生和发展是一个高度异质化的过程,很难有一款产品可以覆盖所有的治疗场景和临床需求,目前已上市ADC药物,各有其优势和劣势。
有的具有更悠久的历史和药物使用记录,但是药物结构相对落后,高昂的价格也是惠及更多患者的障碍;有的在乳腺癌上有惊艳的前期数据,但是安全性还有提升空间,对于中国患者来说,药物可及性目前还存在不确定性;有的具有更为差异化的适应症布局,安全性数据更好,并且定价更低,进入医保后,对于国内患者来说价格的可接受程度要高很多。
另外,ADC是一个非常复杂的结构实体,CMC的可行性和难度对于最终能否开发出来一款成功的ADC药物起了决定性作用。对于ADC来说,不存在一款药物可以通吃绝大多数适应症,同时也不只存在一种研发范式。不同的癌种微环境不同,靶标不同,选用何种抗体、载药、连接子、连接方式都不可能照搬其他癌种的做法,ADC研发的根本原则就是立足于适应症本身,实现安全性和有效性的有机统一,尽可能提高患者的治疗窗口。
高度异质化过程及复杂结构实体,使得泛偶联时代虽然竞争白热化,但药企仍然可以走出一条差异化发展之路。充分发挥自身优势,遵循根本原则,使每一个产品都结合自身特点找准定位,覆盖它最擅长的那一部分临床需求,从而形成差异化竞争策略,最终造福病患。换言之,只要在某一点上取得“一招鲜”的突破,可能就会有“吃遍天”的惊喜。
时代风云变幻,任何选择或定位都将面临变数。我们要做的,不只是研发方面的深钻细研,同时还要考虑自己在赛道上的位置,是满满蓄力,稳扎稳打,还是剑走偏锋,孤注一掷,都需要每位创始人审慎考量。(了解更多资讯,关注VXGZH:贝壳社)
参考资料:
1. 《泛偶联时代,火热的ADC如何引领创新药新浪潮》,药智网,2022-07-04;
2. 《中国ADC药物的战国争雄:谁是王者》,豹变官方号,2022-06-21;
3. 《医药年内跌超20%!“癌细胞克星”ADC有多厉害?会是止跌良药吗》,华夏ETF,2022-08-11;
4.《抗癌神药ADC成下一个PD-1?有药企狂砸百亿高价进场,全球超400个产品在研》,金融界,2022-08-23.


文章评论(0)