跨国药企合作双赢模式:信达携手礼来,塞普替尼终迎商业收获期
塞普替尼是全球首款获批的高选择性RET抑制剂,通过抑制异常RET激酶的活性而发挥作用。自去年10月在中国获批,到如今正式商业化上市,塞普替尼在信达生物手里终于迎来了商业价值绽放。
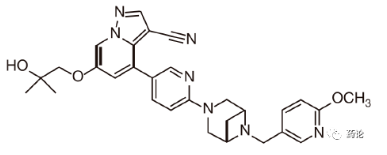
塞普替尼分子结构式
来源:药论网
◆2021年11月,为了拓展中国市场,礼来向中国国家药品监督管理局药品审评中心(CDE)提交了塞普替尼的上市申请,该申请被纳入优先审评审批程序,加速了塞普替尼在中国的获批进程,塞普替尼踏出了“中国之行”的第一步。
◆2022年3月,信达生物从礼来获得塞普替尼在中国的独家商业化权利,全权负责塞普替尼的定价、进口、营销、分销和销售推广,信达正式成为塞普替尼“中国之行”的“护花使者”。
◆2022年9月,塞普替尼获国家药监局批准。用于治疗转染重排基因(RET)融合阳性的转移性非小细胞肺癌(NSCLC)的成年患者,和需要系统性治疗的携带RET突变的晚期或转移性甲状腺髓样癌成人和12岁及以上的儿童患者,以及需要系统性治疗和放射性碘治疗(如适用)难治的RET融合阳性的晚期或转移性甲状腺癌成人和12岁及以上的儿童患者,塞普替尼正式落地中国。
◆2022年9月,FDA批准塞普替尼作为首个且唯一RET抑制剂,不限癌种用于RET基因融合的晚期或转移性实体瘤成人患者,同时常规批准该药用于RET融合阳性的局部晚期或转移性非小细胞肺癌成人患者。
◆2023年3月4日,信达生物开始面向全国供药,这不仅标志着RET变异非小细胞肺癌和甲状腺癌患者迎来新的治疗选择,同时标志着中国精准医疗的又一里程碑。
◆2023年3月6日,信达生物正式发布新闻稿,塞普替尼已在中国商业化上市。至此,塞普替尼正式开启中国之行。
据了解,近期,信达生物公布塞普替尼在已经上架销售的部分药店公开零售价(不考虑优惠赠药等福利)为:32833.5元(80mg*56粒/盒)。通常全国都是统一零售价或差别不大。自公布塞普替尼正式商业化上市喜讯,信达生物在资本市场持续活跃,其股价已连涨多日。
信达生物拥有比较完整的销售体系,商业化方面,信达生物也处于中国生物制药企业的“超一线”,经过多年的发展,信达逐渐具备高效、持续、成体系化的商业化能力。目前拥有超过3000人的营销团队,核心管理人员深耕中国的肿瘤药市场多年,拥有丰富的市场经验和深厚的市场根基,助力信达生物数个商业化产品在市场中乘风破浪。

来源:信达生物官网
信达生物的商业化能力也已经被市场证明,2020年、2021年、2022年上半年,信迪利单抗营收分别为3.08亿美元、4.18亿美元、1.59亿美元。以及PD-1产品销售增长,都备受市场关注;虽然由于“以价换量”医保谈判让信迪利单抗的销售情况在2022年遭遇到前所未有的压力,但商业化团队依然保留着终端渠道的资源,据悉,信达销售团队人均上半年销售收入超过74万元,始终居于商业化成绩前列。
此外,2022年8月,赛诺菲与信达生物围绕两款产品“零首付”合作,着实聚焦业界关注,也让大众看到了信达商业化团队具备的优势。
截止目前,信达生物已推动了8款产品的商业化,包括达伯舒(信迪利单抗)、达攸同(贝伐珠单抗)、苏立信(阿达木单抗)、达伯华(利妥昔单抗)、达伯坦(佩米替尼)、耐立克(奥雷巴替尼,亚盛医药合作产品)、希冉择(雷莫西尤单抗)、睿妥®(塞普替尼)。
礼来多年“钟情”于信达生物,多半得益于信达趋于成熟的商业化能力。正如礼来中国区总裁所述:“基于我们在过往和信达生物的成功合作,以及信达生物在和礼来共同开发和商业化信迪利单抗所建立起的良好商业化能力,我们认为这次将塞普替尼授权给信达生物是一个非常好的做法,和信迪利单抗有很强的互补性。”
信达与礼来堪称医药界一对模范搭档,此次礼来牵手信达完成塞普替尼中国市场的商业化,并非两家公司的第一次合作,追根硕源,两者的第一次“结合”发生在8年前。
◆2019年8月,信达生物与礼来还将合作延伸至糖尿病领域,信达生物获授权在中国开发和商业化礼来的一个潜在全球最佳新型临床阶段糖尿病药物。
◆2020年8月,礼来与信达生物进一步扩大信迪利单抗的合作范围。礼来以10.25亿美元的首付款+里程碑费用以及销售双位数分成,获得PD-1抑制剂信迪利单抗在中国以外地区的独家许可。礼来一次性支付的首付款,之后信达生物还会陆续收到销售里程碑付款,以及产品上市后每年双位数的销售分成。
◆2021年3月,FDA拒绝了信迪利单抗用于治疗新诊断的非鳞状非小细胞肺癌的上市申请,并批评礼来仅使用了信迪利单抗在中国地区进行的关键临床数据,将实验疗法与过时的方案进行比较。双方的合作也正面临巨大的考验,也因此信达生物未获得任何潜在里程碑付款。同年12月礼来对外透露,在中国的PD-1销售团队将收缩,这是两个公司在合作了长达六年的时间里第一次遗憾分手。
◆2021年1月起,信达生物与礼来也重新对信迪利单抗在国内的销售进行了安排。据悉,目前信迪利单抗在国内市场的推广也已经全部交给信达生物来完成。经历短暂分手,双方重新“牵手”。
◆2022年3月,礼来和信达生物共同宣布双方将深化战略合作,并达成两项合作协议:礼来授予信达生物在中国大陆进口、销售、推广和分销雷莫西尤单抗和塞普替尼获批后独家商业化权利,以及授予信达生物享有塞普替尼未来在中国大陆商业化权利的优先谈判权。
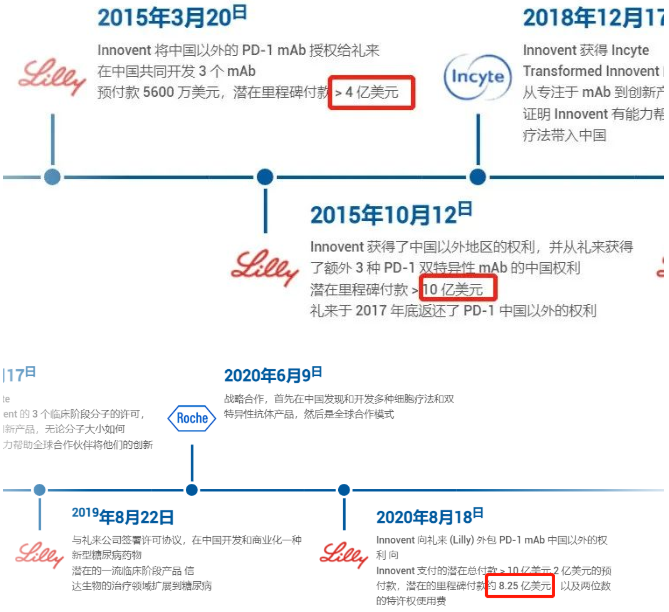
信达与礼来的合作,
来源:bioSeedin柏思荟
从市场角度来看,国内药企与跨国药企间的分分合合都已成为业内常态,这也是一种双赢的模式。回顾携手的八年,礼来对于信达生物的可谓是“不离不弃”,信达生物对于礼来回敬的是“生死相依”的坚定。
时至今日,信达生物已是中国生物制药企业的“领跑者”,正努力向着“全球领先的生物制药公司”进军,相信礼来与信达生物未来还会一起创造更多合作战绩,毕竟成功密码,向来是强强联合,路才会越走越远。
参考资料:
1、信达生物官网
2、《合作总交易超25亿美元!信达与礼来再度携手,深耕肿瘤小分子及抗体药开发》bioSeedin柏思荟,2022年3月28日
3、《礼来退还信达生物PD-1单抗》抗体圈,2022年12月3日
4、《信达与赛诺菲“零首付”合作,叠加高管离职、架构调整获高度关注!信达独家回应:不存在现金流压力!》医药经济报,2022年8月8日


文章评论(0)