动辄上百万美元的基因疗法,卖得出去吗?
Lyfgenia目前已启动并运行 64 个治疗中心,其基础设施是为 2022 年和 2023 年推出的另外两种基因疗法 Zynteglo (betibeglogene autotemcel,输血依赖性 β 地中海贫血 TDT) 和Skysona (elivaldogene autotmcel,脑性肾上腺脑白质营养不良 CALD) 而建立的,因此bluebird 在起跑上占据了先机。
Vertex方面,根据它们的报告,截至 4 月中旬已启动 25 个授权治疗中心,而且地理覆盖范围更广,在世界多个地区启动了中心,包括欧洲、沙特阿拉伯和巴林。Vertex 表示,截至 4 月中旬,已收集了 5 名患者的细胞,准备输注 Casgevy。而Bluebird 报告称,截至 5 月中旬,仅一名新患者开始接受治疗。但需要指出的是,Casgevy同时获得了针对SCD 和 TDT 的批准,而Bluebird 的 Lyfgenia 仅获得了 SCD 的批准。两家公司都没有报告 Lyfgenia 或 Casgevy 的销售收入,因为它们仅在患者实际接受输注之后记录销售额,而不是在患者开始治疗时。从目前的状况来看,Vertex 的财政状况似乎更加有利,他们的纤维化资产为其带来大量的收入和潜在收入,而 Bluebird报告称第一季度末仅有 2.64 亿美元现金。
Bluebird预计,随着患者病情的缓解以及医疗保险覆盖的逐渐完善,它们的三种基因疗法受益将在今年下半年实现增长。Lyfgenia可能于今年第三季度正式开始销售并实现收益。对于它们已经获批的三种基因疗法,bluebird预测 2024 年将有 85-105 名新患者开始接受治疗。患者在进行细胞收集之后的一到两个季度就可以开始接受输注,彼时将实现疗法的收益。
在报销方面,Bluebird 表示Lyfgenia的保险覆盖已经取得了进展,其设定的批发采购价格(WAC)为 310 万美元。商业保险和Medicaid受保人均已获得 Lyfgenia 的事先授权。Bluebird表示,它们与国家商业付款组织签署了多项基于结果的协议。Bluebird还表示,Zynteglo和Skysona同样在Medicaid或商业保险方面没有被拒绝。公司预计在产品组合中,根据产品、付款人和使用基于结果的协议的情况,折扣后的毛利率将在20%至25%之间。Bluebird在第一季度获得1.86亿美元的收入,主要来源于Zynteglo。
除美国外,Casgevy 还在欧洲、英国、沙特阿拉伯和巴林获得批准。Vertex 表示,在美国以外的地区的商业开发进展不错,尤其是中东地区,那里的镰状细胞病患病率很高。Vertex估计,沙特阿拉伯和巴林约有 23000 名患有 SCD 或 TDT 的患者可能有资格接受 Casgevy,这可能比美国有更大的机会。Vertex拒绝透露在美国以外市场的定价标准。Casgevy的美国WAC价格为220万美元。
Elevidys 在 2023 年 6 月获得 FDA 加速批准后取得了良好的开端,已经收获了超过 3.34 亿美元,在所有基因疗法中表现突出。但目前Elevidys只针对四至五岁的DMD患儿获批,Sarepta已向FDA提交生物制品许可申请(BLA)的疗效补充文件,旨在争取将Elevidys的适应证拓展至涵盖所有年龄段的DMD患者。
Elevidys 2024年第一季度的营收为 1.339 亿美元,略高于2023年第四季度的 1.312 亿美元。Sarepta首席执行官Doug Ingram认为,4至5岁的DMD患儿中大约有一半未得到诊断,因此Elevidys的市场规模仍然有很大的拓展空间。6月21日,FDA将对Elevidys的sBLA申请进行最终决定。不利的是,它的上市后验证性研究没有能够达到主要终点。有利的是,目前业界普遍认为FDA不仅不会撤回其加速批准,而且升级为全面批准的可能性很大。
在 4 月 24 日 BioMarin 第一季度销售和收益电话会议上,Hardy继续向投资者传递悲观信息,甚至表示,随着管理层进行审查,Roctavian 的未来并不确定。
Hardy表示,尽管BioMarin在美国、德国和意大利的保险覆盖方面取得了进展,但让患者接受治疗所需的其他步骤仍然构成挑战。虽然Roctavian在德国的价格已于12月确立并发布,但次级保险公司已经增加了新的报销障碍。在美国的报销合同也面临着纷繁复杂的各类挑战。总体来说,药是好药,但是否能够到达患者手中并实现盈利,中间还有很多保险方面的障碍。
Roctavian 2024年第一季度仅仅为BioMarin带来了80万美元净销售额的收入。意大利的第一位患者于今年四月份开始接受治疗。与 Sarepta 的Elevidys面临的“独孤求败”不同的是,Roctavian针对的是一个已经存在着激烈竞争的市场。患者不仅疗法选择不少,而且价格体系也具有足够的差异性。因此患者和付款人可能更不愿意尝试新的昂贵的替代方案。
面对这种局面,Hardy 表示BioMarin 正在继续投资 Roctavian,包括对日本市场的开发。对于Roctavian的前途,Hardy认为有三种出路:自己杀出一条血路,励志剧情;重新设定资产的商业目标,同时调整投资水平,无为而治;或者剥离该资产,归彼大荒。如果选择第三条路线,将是对BioMarin的沉重一击。它们几年前曾经将Roctavian视为重磅炸弹憧憬的。BioMarin已经开发了这款疗法十年之久。如今行至水穷处,却有可能无法坐看云起时。
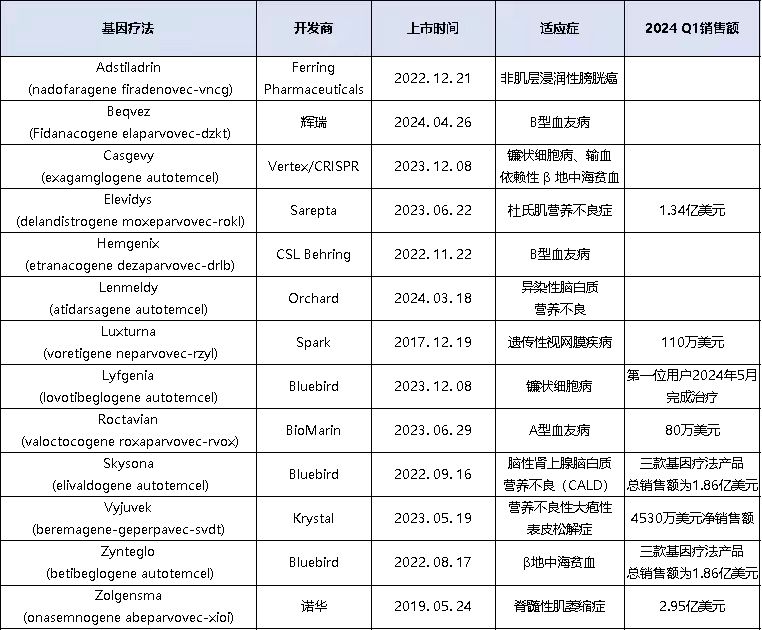
表1. FDA批准的基因疗法
参考:
Merrill, J. Gene Therapy Q1 Roundup: The Struggle Is Real. Scrip. 09. 05. 2024.


文章评论(0)