FDA首开”在家”新冠病毒检测绿灯,专家们看法不一
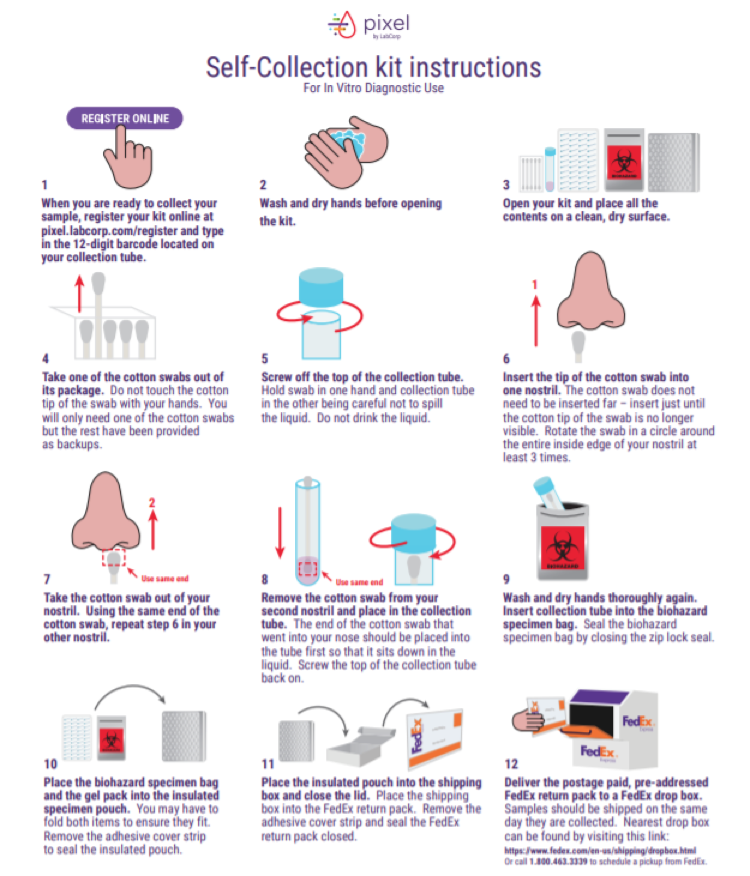
在获得FDA的批准后,LabCorp也发布了一段视频及图片,解释了如何采集,管理和寄送样本,参见下图:
根据LabCorp官网,目前该试剂盒官网标价为119美元。用户可以使用工具包里提供的一个专门设计的棉签,只需走到鼻腔,而不是更深的鼻咽处进行样本采集。然后使用随附的运输包将样本寄送到实验室进行检测,实验室在收到样本后一到两天内即可出结果。
LabCorp公司表示,该产品将首先提供给医务工作者及其他一线员工,并计划在未来几周内按照医生的指示向大多数州的消费者提供这些测试。
彼时,FDA对这种在家收集样本表达了一些担忧:“样品收集介质的成分在家庭环境中是否可以安全使用(由于某些成分可能是有毒的),适当的装运以及样品的适当稳定性,考虑到收集和测试之间的时间间隔以及潜在的影响运输条件(例如,如果标本坐在热卡车上)。”
然而美国的疫情形势,尚不容乐观。根据美国约翰斯·霍普金斯大学疫情实时监测系统显示,截至美东时间4月21日下午6时,美国已至少有新冠病毒感染病例820104例,包括死亡病例44228例。
显然考虑到目前美国疫情的发展,在扩大检测范围的压力之下,FDA最近更新了其指导方针,指出它正在与家庭测试提供者合作,以确定向公众提供这些测试的最佳方式,因为它认为通过安全和准确的方式,扩大COVID-19测试可用性对公众健康有价值。
FDA指出,目前只有LabCorp公司的COVID-19 RT-PCR检测获得了这一授权,而且FDA仍然要求任何此类检测必须有EUA才能提供服务,无论是否授权医疗专业人员通过远程医疗指导下在家中进行检测,都要有EUA。一些实验室利用FDA指南中的例外情况,为在家进行血清学检测提供了便利,但该机构并不认为这些检测可以确诊COVID-19病例。
据《纽约时报》报道,相关医学专家表示,家庭测试可以增加消费者的便利性,并减少人们去医疗机构的需求,避免交叉感染。
耶鲁大学医学院临床微生物实验室副主任Sheldon Campbell博士评价说:“这不是改变游戏规则的东西,但这可能是我们在应对庞大而又混乱的(新冠疫情)难题中的一部分,做尽可能多的检测来阻止COVID-19。” “家庭测试将为远程医疗提供支持,并帮助交通困难的患者和难以到达的地方进行检测。”
但是,专家们也警告说,与专业卫生部门进行的冠状病毒的金标准标本采集相比,鼻拭子的测试准确性较差,这涉及将长鼻拭子通过鼻子向上插入喉咙后部。例如,来自法国的一项经过同行评审的小型研究报告说,上周使用鼻拭子进行冠状病毒检测的假阴性率要高于较长的拭子。
同时,在家采样也可能会增加人们获取测试结果所花费的时间。
然而,值得一提的是,就在LabCorp宣布其家庭COVID-19检测试剂盒获得FDA批准授权的同一天,LabCorp同时宣布正在考虑一些削减开支的计划,包括延迟招聘、裁减临时员工等等。
LabCorp首席执行官Adam Schechter表示,在与客户“推迟研究”药物和治疗的过程中,LabCorp的财务状况遭受了打击,与此同时“监测患者的健康状况和诊断测试”业务也有所减少。
在回应媒体的询问时,LabCorp首席沟通官Patti Kushner解释了降低成本的原因。
她说:“我们支持COVID-19测试和相关患者研究的承诺和能力始终如一,我们将继续创新以推进测试和治疗。”
“不幸的是,COVID-19疫情正以客户推迟研究和计划的形式影响我们的常规业务,并且也导致我们监测患者健康和常规诊断的业务减少。
“我们正在决定减少这次疫情期间的开支,并正在采取审慎的措施,在确保我们业务的长期发展的同时,保留员工的工作机会。”
不过Kushner强调:公司并不准备大规模裁员。
所有人都在等待这场疫情的结束,尽管谁也不知道何时才能结束。根据FDA官网消息,截至目前,已经有43个新冠病毒检测产品获FDA紧急使用授权。
编辑:阿尔卑斯
3.https://www.biopharmadive.com/news/labcorp-test-gets-1st-fda-nod-for-at-home-coronavirus/576450/


文章评论(0)