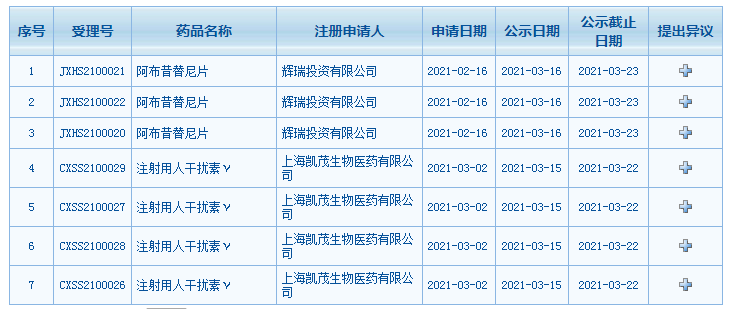
2款药物获CDE批准纳入拟优先审评
近日,国家药品监督管理局审评中心(CDE)官网显示,辉瑞的阿布昔替尼片及上海凯茂生物医药有限公司的注射用人干扰素γ正式纳入拟优先审评公示。
截图自CDE官网
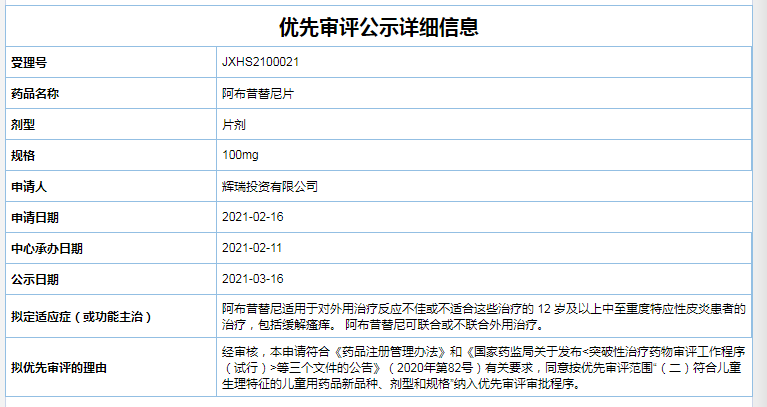
一、阿布昔替尼片
阿布昔替尼片是辉瑞开发的一种口服小分子选择性Janus激酶(JAK) 1抑制剂,根据现有三期临床数据显示,阿布昔替尼治疗特应性皮炎与安慰剂相比有良好的疗效。2020年10月阿布昔替尼片获得了FDA优先审评资格用于治疗12岁及以上中重度AD患者,预计2021年4月获批上市。
而阿布昔替尼此次在国内申请上市包含50mg、100mg及200mg三种规格,适应症为治疗反应不佳或不适合这些治疗的 12 岁及以上中至重度特应性皮炎患者的治疗,包括缓解瘙痒。 此外,阿布昔替尼可联合或不联合外用治疗。按照“(二)符合儿童生理特征的儿童用药品新品种、剂型和规格”纳入优先审评审批程序。
截图自CDE官网
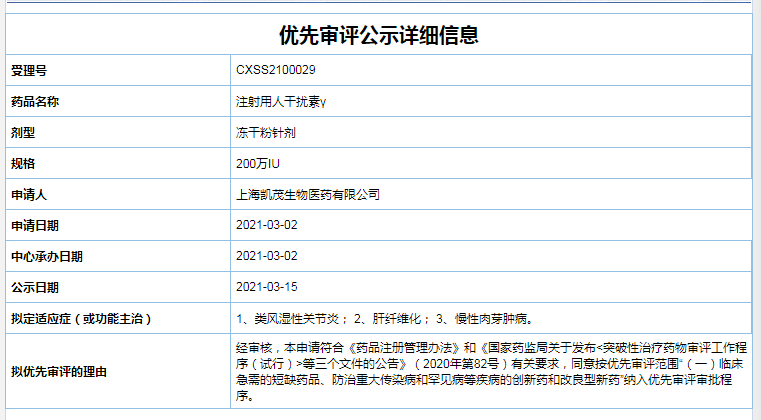
二、注射用人干扰素γ
干扰素γ具有较强的免疫调节功能,能增强抗原递呈细胞功能,加快免疫复合物的清除和提高吞噬异物功能,对淋巴细胞具有双向调节功能,提高抗体依赖的细胞毒反应,增强某些免疫活性细胞HLA—Ⅱ类抗原表达。
上海凯茂生物医药注射用人干扰素γ可分为100万IU和200万IU两种规格,可用于类风湿性关节炎、肝纤维化、慢性肉芽肿病以及孟德尔遗传分枝杆菌易感性疾病。而此次则以优先审评范围“(一)临床急需的短缺药品、防治重大传染病和罕见病等疾病的创新药和改良型新药”纳入优先审评审批程序。
截图自CDE官网
目前注射用人干扰素γ在国内仅上海凯茂生物医药获批。


文章评论(0)