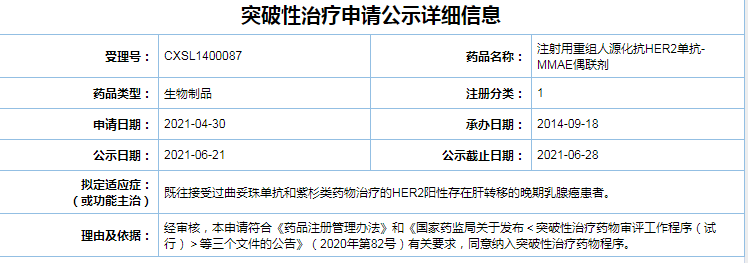
荣昌生物维迪西妥单抗乳腺癌适应症获CDE拟突破性疗法认定
6月21日,据国家药品监督管理局药品审评中心(CDE)官网最新公示,荣昌生物的注射用重组人源化抗HER2单抗-MMAE偶联剂最新适应症被纳入拟突破性治疗品种名单,拟用于既往接受过曲妥珠单抗和紫杉类药物治疗的HER2阳性存在肝转移的晚期乳腺癌患者。
截图自CDE
据悉,此次荣昌生物的注射用重组人源化抗HER2单抗-MMAE偶联剂(维迪西妥单抗、RC48)被纳入拟突破性疗法基于其在2021年ASCO年会上公布的最新数据。
其中,在RC48用于HER2阳性(IHC 3+, 或IHC 2+/FISH+) 和HER2低表达(IHC 2+/FISH-, 或 IHC 1+) 的晚期或转移性乳腺癌患者的两项研究中,截止2020年12月31日,共入组70例HER2阳性患者,48例HER2低表达患者。数据显示,在HER2阳性亚组中,经RC48治疗,1.5、2.0及2.5mg/kg剂量组患者的ORR分别为22.2%、42.9%和40.0% ,mPFS分别为4.0个月、5.7个月和6.3个月;在HER2低表达亚组中,经RC48治疗,患者的ORR为39.6%,mPFS为5.7个月。
值得一提的是,6月9日,国家药品监督管理局已正式批准维迪西妥单抗上市,用于治疗至少接受过2种系统化疗的HER2过表达局部晚期或转移性胃癌(包括胃食管结合部腺癌)患者,成为国内首个通过自主研发获批上市的ADC药物。此外,2020年12月,维迪西妥单抗曾被CDE纳入突破性治疗品种,拟用于既往经过化疗失败后进展的HER2过表达局部晚期或转移性尿路上皮癌患者。


文章评论(0)