超40亿美元 ! 8月国内12起license in/out,涉及荣昌生物、石药、恒瑞…..
2021年8月,据不完全统计,国内药企共发生8起license in交易及4起license out交易,共披露的交易金额超40亿美元,且license out交易额高达34.1亿美元,再次刷新历史记录。
其中,荣昌生物通过license out维迪西妥单抗获得26亿美元的收益,成为本月金额最大交易,亦刷新了中国制药企业单品种海外授权交易的最高纪录。近年来随着license out交易的持续火爆,该信号也被认为是国内创新药企开始国际化的重要标志。
此外,石药集团本月共完成2起交易,占交易数量首位,且同时涉及引进及出海。
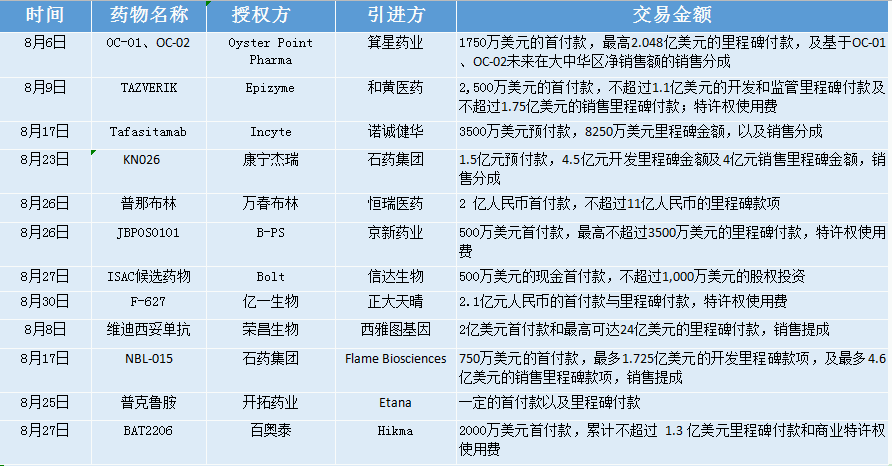
2021年8月国内药企license in/out交易
贝壳社制图
以下为8月份国内药企license in/out交易具体情况:
引进方:箕星药业
根据协议,Oyster Point Pharma可获得1750万美元的现金首付款,以及最高0.75%的箕星药业股份,其中一半受制于预先规定的可行权条件。此外,还有资格获得最高2.048亿美元的里程碑付款,及基于OC-01、OC-02未来在大中华区净销售额的销售分成。
据悉,OC-01(varenicline)鼻喷雾剂是多剂量包装、不含防腐剂的高选择性胆碱能激动剂鼻喷雾剂,用以治疗干眼症和神经营养性角膜病变的症状和体征。2020年12月,Oyster Point Pharma已向FDA提交了OC-01(varenicline)鼻喷雾剂的新药上市申请,用于治疗干眼症的症状和体征。OC-02(simpinicline)鼻喷雾剂是一种高选择性胆碱能激动剂,目前处于临床开发阶段。
引进方:和黄医药
根据协议,Epizyme可获得2,500万美元的首付款,并有资格额外收取不超过1.1亿美元的开发和监管里程碑付款(涵盖最多八个其他潜在适应症)以及不超过1.75亿美元的销售里程碑付款。Epizyme亦有资格收取根据TAZVERIK在大中华区的年度净销售额计算介于百分之十的中位数至百分之二十的低数位之特许权使用费。
据悉,TAZVERIK是由Epizyme开发的EZH2甲基转移酶抑制剂,通过抑EZH2,调节参与细胞周期调控和终末分化基因的转录,从而抑制肿瘤细胞增殖。目前该药物已获FDA批准用于转移性或局部晚期上皮性肉瘤的16岁及以上的成人及儿童患者,及复发或难治性滤泡性淋巴瘤的成人患者,其肿瘤经FDA批准的试验检测呈EZH2突变阳性,并且之前已经接受至少两次全身治疗。
引进方:诺诚健华
根据协议,Incyte可获得3500万美元预付款,并有资格获得至多8250万美元潜在的开发、注册和商业化里程碑付款,以及分级销售分成。
据悉,Tafasitamab是一款靶向CD19的人源化单克隆抗体,通过对Fc结构域优化显著强化了抗体依赖性细胞介导的细胞毒作用(ADCC)和抗体依赖性细胞吞噬作用(ADCP),从而经细胞凋亡和免疫效应机制介导B 细胞肿瘤的裂解。Tafasitamab已获FDA加速批准,与来那度胺联合用于治疗复发或难治性弥漫性大 B 细胞淋巴瘤(DLBCL)成人患者,包括由低恶性淋巴瘤演进而来的DLBCL ,以及不符合自体干细胞移植(ASCT)条件的患者。
引进方:石药集团
根据协议,康宁杰瑞可获得1.5亿元预付款,4.5亿元开发里程碑金额及4亿元销售里程碑金额。此外,还将获得两位数比例的销售分成。
据悉,KN026是康宁杰瑞研发的具有自主知识产权的靶向HER2的双特异性抗体药物,可同时结合HER2的两个非重叠表位,导致HER2信号阻断,效果优于曲妥珠单抗或者帕妥珠单抗单用,并达到曲妥珠单抗和帕妥珠单抗联用的效果,如展示出更高的亲和力,在HER2阳性肿瘤细胞株中具备优效的肿瘤抑制作用。
目前KN026正在中美同步展开多项 I/II 期临床研究,用于评估治疗HER2中低表达或HER2阳性乳腺癌、晚期HER2阳性胃癌和胃食管结合部癌及其它HER2阳性实体瘤等适应症的潜力。
引进方:恒瑞医药
根据协议,万春布林可获得2亿人民币首付款,并在达到相应的研发里程碑和商业化里程碑时不超过11亿人民币的费用。此外,还将获得恒瑞医药1亿人民币的股权投资。
据悉,普那布林是全球首个刺激树突状细胞成熟,增强抗原递呈的免疫小分子药物,有望成为抗PD-1/L1抗体以外免疫治疗的新基石。且普那布林与抗PD-1抗体和其他免疫药物的联合用药方案,已经在7个实体瘤上开展早期临床。并在二/三线小细胞肺癌的I期研究中,无论患者前期是否接受过抗PD-1单抗等免疫检查点抑制剂的治疗,联合疗法都取得了显著的抗肿瘤效果。
引进方:京新药业
根据协议,B-PS可获得500万美元首付款,最高不超过3500万美元的里程碑付款,以及按产品销售总额提成的特许权使用费。
据悉,JBPOS0101通过结合代谢型谷氨酸受体减少神经元放电,属于“first-in-class”产品,目前全球范围内尚无同靶点药物上市,JBPOS0101更是被美国国立卫生研究院红皮书列为最具潜力的癫痫药物。临床前研究显示,JBPOS0101对多种癫痫动物模型安全有效;同时已有临床数据显示,JBPOS0101有效控制婴儿痉挛症发作和光敏性癫痫发作(常作为局灶性癫痫概念验证性试验)。
引进方:信达生物
根据协议,Bolt可获得500万美元的现金首付款,及潜在未来不超过1,000万美元的股权投资。此外,在各自区域达到开发及销售里程碑后,两家公司均有资格获得相应的里程碑付款和特许权使用费。
据悉,Bolt的专有Boltbody™平台由抗体-免疫刺激偶联物(ISAC)组成,通过激活髓样细胞,增强适应性免疫肿瘤杀伤反应,将冷肿瘤转化为免疫学上热肿瘤,将肿瘤暴露在免疫系统中,继而由肿瘤杀伤细胞处理。
引进方:正大天晴
根据协议,亿一生物可获得最高2.1亿元人民币的首付款与里程碑付款,以及两位数的分级净销售额特许权使用费。
据悉,F-627是一种重组融合蛋白,以同二聚体的形式存在,其中两个G-CSF-Fc分子通过分子的Fc片段之间形成的二硫键共价连接。通过与其G-CSF受体进行特异性结合,F-627可刺激中性粒细胞前体和成熟中性粒细胞的存活、增殖、分化和功能,旨在治疗癌症患者在化疗后出现的中性粒细胞减少症(CIN)。
引进方:西雅图基因
根据协议,荣昌生物可获得2亿美元首付款和最高可达24亿美元的里程碑付款。此外,荣昌生物将获得维迪西妥单抗在西雅图基因授权区域净销售额从高个位数到百分之十几的梯度销售提成。
据悉,维迪西妥单抗是一款靶向HER2的新型ADC新药,具有对HER2的高亲和力和细胞内吞效率。今年6月,该药已获NMPA有条件批准上市,成为首个用于治疗局部晚期转移性胃癌的国产ADC新药;近日,CDE官网显示,荣昌生物的注射用维迪西妥单抗拟纳入优先审评,用于治疗既往接受过系统化疗且HER2表达为免疫组化检查结果为2+或3+的局部晚期或转移性尿路上皮癌患者,这将是其获批的第2项适应症。
引进方:Flame Biosciences
根据协议,NovaRock可获得750万美元的首付款,最多1.725亿美元的开发里程碑款项,及最多4.6亿美元的销售里程碑款项。此外,还有权获得按许可产品于大中华以外地区的销售净额的若干百分比销售分成。
据悉,NBL-015是一种全人源抗Claudin 18.2单克隆抗体,并经过蛋白工程优化,具有增强的ADCC、CDC和ADCP效应。此外,临床前研究显示,NBL-015具有免疫原性低、安全性高、亲和力强及抗肿瘤活性高的潜在优势,有望成为治疗胰腺癌和胃癌的“best-in-class”靶向药物。截至目前,NBL-015已处于临床开发阶段,并已获FDA授予的治疗胰腺癌和胃癌(包括食道胃结合部癌)孤儿药资格。
引进方:Etana
根据协议,开拓药业可获得一定的首付款以及里程碑付款,还将获得普克鲁胺在印尼上市销售相关的经济利益。
据悉,普克鲁胺是开拓药业自主研发的新一代雄激素受体拮抗剂,自2020年初新冠疫情大流行以来,开拓药业迅速开启普克鲁胺用于新冠治疗的研究。目前普克鲁胺正在美国、南美洲(含巴西)、欧盟、亚洲等国家和地区进行新冠治疗的三项全球多中心III期临床试验,并于2021年7月获得巴拉圭授予首个紧急使用授权(EUA)。
引进方:Hikma
8月27日,百奥泰宣布与 HikmaPharmaceuticals USA Inc.(Hikma)签署授权许可与商业化协议,将BAT2206(乌司奴单抗)注射液在美国市场的独占商业化权益有偿许可给Hikma。
根据协议,百奥泰可获得2000万美元首付款,累计不超过1.3亿美元的里程碑付款和商业特许权使用费,以及两位数百分比的净销售额作为供货价。
据悉,BAT2206 是一款靶向白细胞介素IL-12和IL-23共有的p40亚基的全人源单克隆抗体。其中,IL-12和IL-2是天然产生的细胞因子,能够参与炎症和免疫应答过程,可以与p40亚基以高亲和力特异性地结合,阻断其与细胞表面受体结合,从而破坏IL-12和IL-23介导的信号传导和细胞因子的效应。目前,该药正在开展治疗斑块状银屑病的全球 III 期临床研究。


文章评论(0)