AACR前瞻:KRAS/WRN靶向突破与ADC/双抗免疫创新
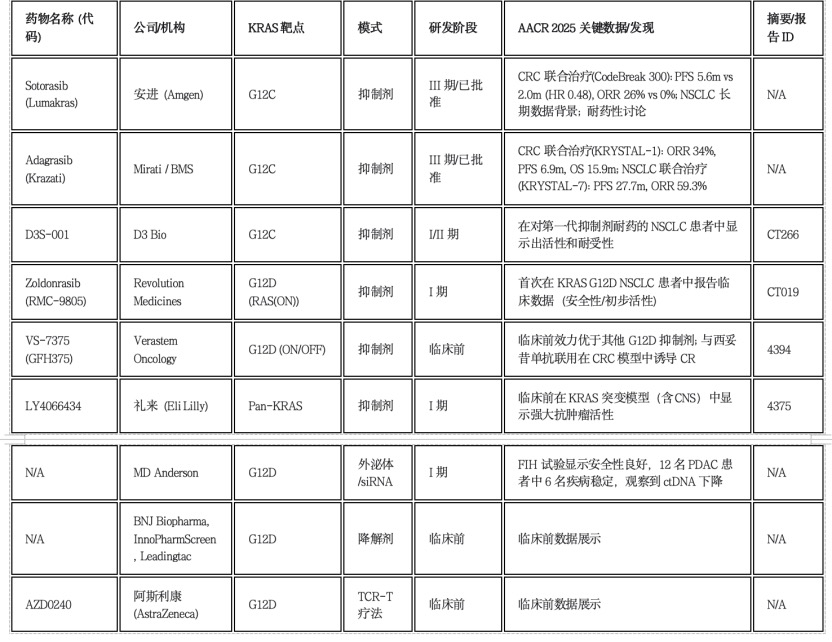
注:N/A表示摘要/报告ID在提供的材料中未明确说明或不适用。已批准药物的数据可能涉及先前会议报告或近期批准信息,作为AACR 2025讨论的背景。
KRAS G12C抑制的关键观察在于联合治疗,尤其在CRC中。Sotorasib和Adagrasib单药在NSCLC中初步获批显示了潜力,但在CRC中的疗效相对有限。临床前研究揭示EGFR通路的上调是CRC产生耐药的关键机制之一。随后的III期(CodeBreak 300)和I/II期(KRYSTAL-1)试验结果一致表明,KRAS G12C抑制剂联合抗EGFR抗体(Sotorasib+帕尼单抗,Adagrasib+西妥昔单抗)相较于历史单药数据或标准治疗,在经治CRC患者中显著提高了ORR和PFS。
KRAS G12C抑制的另一趋势为新一代药物聚焦克服耐药。第一代抑制剂面临原发性和获得性耐药的挑战。D3 Bio明确将D3S-001定位为旨在增强靶点结合的新一代抑制剂,其AACR 2025报告聚焦于在对第一代药物耐药患者中的活性。这突显了一个关键的研发方向:设计出(可能具有不同结合动力学或特性)能够特异性解决限制第一代药物持久性的耐药机制的分子。
2. KRAS G12D抑制剂:靶向普遍存在的“困难”突变
KRAS G12D一直是主要的未满足需求,尤其是在PDAC中。AACR 2025见证了首个直接G12D抑制剂(Revolution Medicines的Zoldonrasib)临床数据的发布。与此同时,会议还展示了另一款抑制剂(Verastem的VS-7375)的临床前数据、多种降解剂甚至TCR疗法。这种针对同一特定突变 (G12D) 的多种不同治疗模式(抑制剂、降解剂、细胞疗法)的同时出现,凸显了研发界对攻克这一挑战性靶点的强烈关注和快速进展。
3. 泛KRAS及其他KRAS靶向策略
礼来的泛KRAS抑制剂(LY4066434)旨在同时应对多种KRAS突变,可能提供更广泛的适用性,但需要精细管理其选择性。
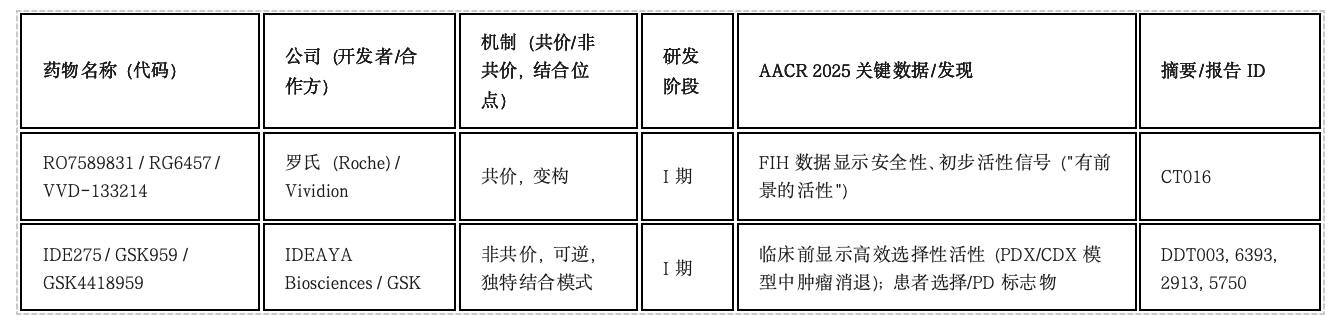
注:FIH = First-in-Human (首次人体试验)
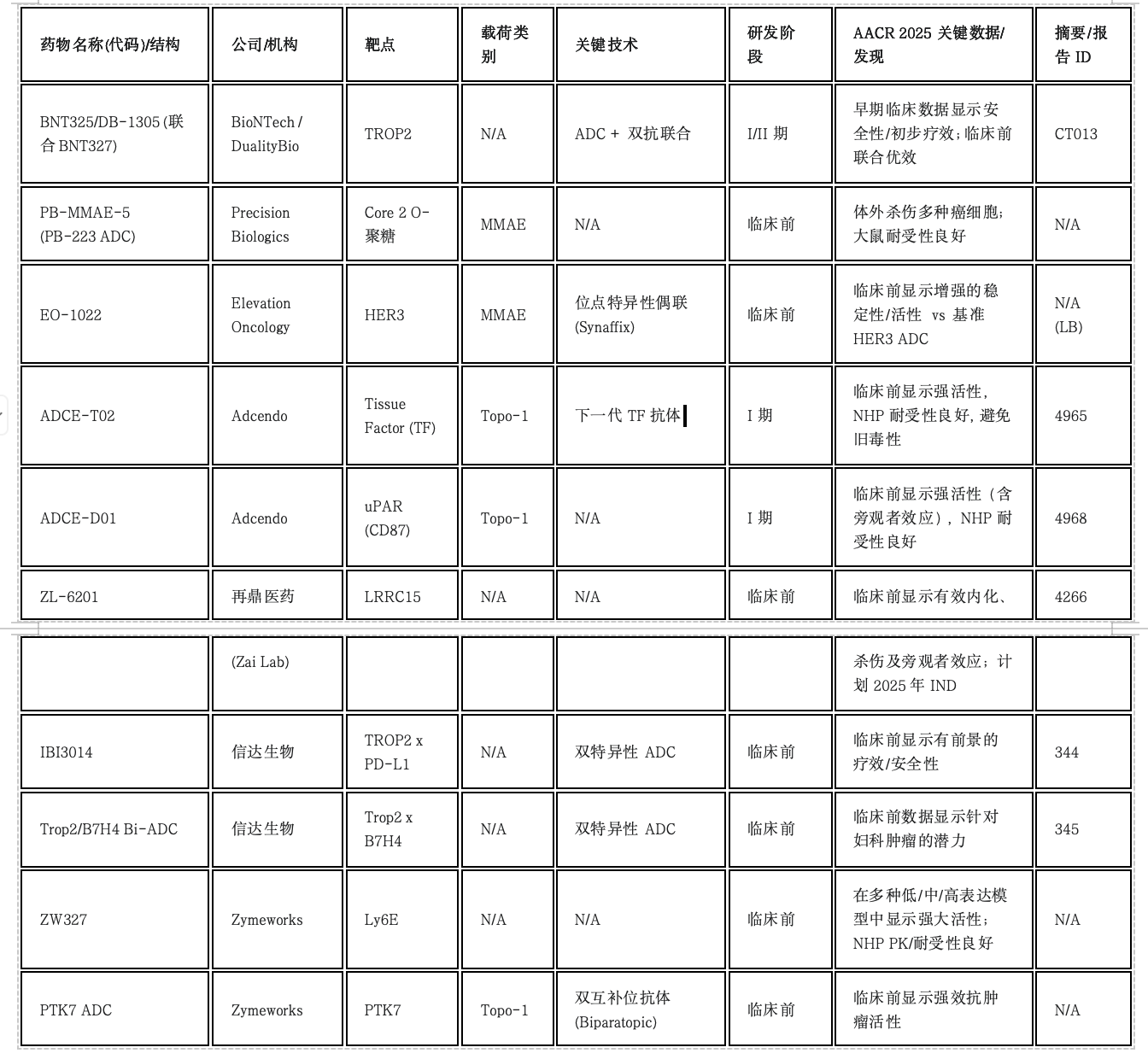
注:N/A表示未在摘要中明确说明或不适用;LB表示后期突破性摘要。
此外,ADC的设计正变得日益复杂。Elevation Oncology强调其EO-1022 (HER3 ADC) 采用位点特异性偶联技术以获得潜在更优的性质。Zymeworks为其PTK7 ADC使用了双互补位抗体以增强结合/内化。信达生物展示了两款双特异性 ADC (TROP2xPD-L1, Trop2xB7H4),旨在将ADC杀伤与检查点阻断或双靶点结合整合到单一分子中。这一趋势反映了通过先进的抗体工程和整合超越简单载荷递送的额外功能,来努力提升ADC性能(治疗指数、疗效)。
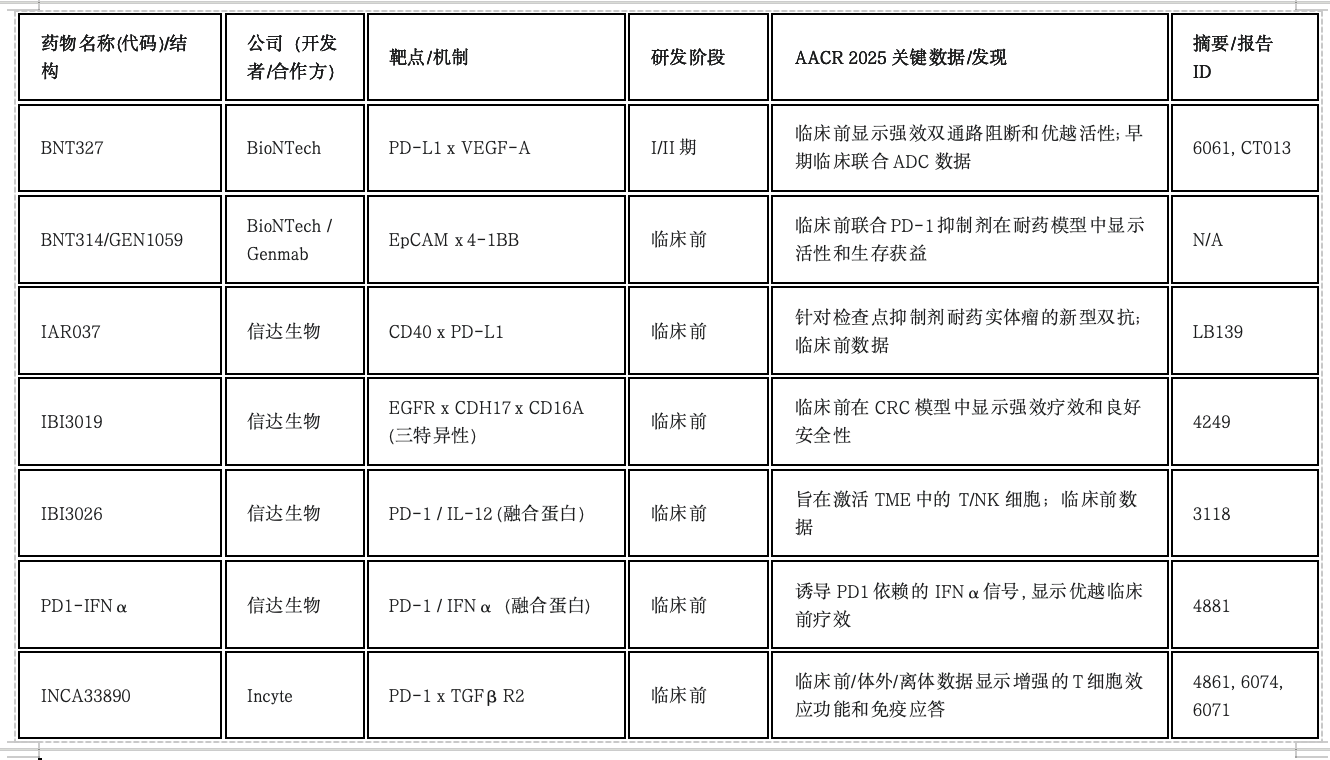
注:N/A表示摘要/报告ID在提供的材料中未明确说明。
信达生物不仅展示了双特异性抗体,还展示了一款三特异性抗体(IBI3019: EGFR x CDH17 x CD16A),旨在实现强效的CRC活性,以及多款将抗PD-1与细胞因子(IL-12, IFNα)结合的融合蛋白。这表明分子工程正朝着更复杂的方向发展,以同时作用于多个靶点或通路,可能提供相比简单双特异性形式更强的特异性或协同疗效。
WRN解旋酶抑制剂作为针对MSI-H/dMMR肿瘤的新型合成致死策略,不同化学类型(共价 vs 非共价)抑制剂(如IDE275)的平行开发预示着该领域未来可能出现多样化的治疗选择。
在免疫治疗领域,ADC领域持续创新,靶点范围显著拓宽,涵盖了Core 2 O-聚糖、uPAR、LRRC15、Ly6E、PTK7、HER3等新抗原,同时Topo-1抑制剂等新型载荷得到应用。更重要的是,ADC工程化水平不断提高,位点特异性偶联、双互补位抗体以及结合检查点阻断或双靶向功能的双特异性ADC成为研发热点,旨在提升治疗指数和疗效。
双特异性/多特异性抗体的发展超越了单纯的双检查点组合,更多地将检查点阻断与靶向免疫抑制通路(VEGF、TGFβ)、共刺激信号(CD40)或细胞因子递送(IL-12、IFNα)相结合。三特异性抗体和融合蛋白等更复杂结构的出现,预示着通过单一分子调控多重免疫机制的潜力。
总体来看,AACR 2025展示的研究突显了几个关键趋势:联合治疗策略无处不在,贯穿靶向治疗和免疫治疗的各个方面;克服耐药是驱动药物设计和联合方案开发的核心动力;基于生物标志物的个体化/精准治疗方法(如MSI-H用于WRN抑制剂,KRAS突变分型)日益重要;以及新靶点(如WRN、KRAS G12D)从基础研究向临床转化的速度加快。
这些进展描绘了肿瘤治疗领域充满活力的未来图景。然而,许多新兴疗法和联合方案仍处于早期开发阶段,需要更成熟的数据,特别是总生存期数据,来最终确立其临床价值。

AACR官网
https://www.prnewswire.com/news-releases/innovent-to-present-preclinical-data-of-multiple-novel-molecules-at-the-2025-aacr-annual-meeting-302412693.html


文章评论(0)