全球第二款!南京传奇宣布向FDA提交BCMA CAR-T疗法BLA申请
12月22日,强生旗下杨森(Janssen)公司和传奇生物同时宣布,开始向美国FDA滚动提交合作开发的靶向B细胞成熟抗原(BCMA)的CAR-T疗法西达基奥仑赛(cilta-cel)的生物制品许可申请(BLA),用于治疗复发/难治性多发性骨髓瘤成人患者。
多发性骨髓瘤(MM)是一种尚且无法治愈的血液癌症,是由于称为浆细胞的白细胞癌变造成。癌变的浆细胞在骨髓中迅速扩散,并取代骨髓中的正常细胞。虽然一些多发性骨髓瘤患者没有症状,但大多数确诊患者的症状可能包括骨折或疼痛、红细胞计数低、疲倦、钙水平高、肾脏问题或感染。虽然目前有很多治疗MM的疗法,但是大多数患者在获得缓解之后疾病仍然会复发。
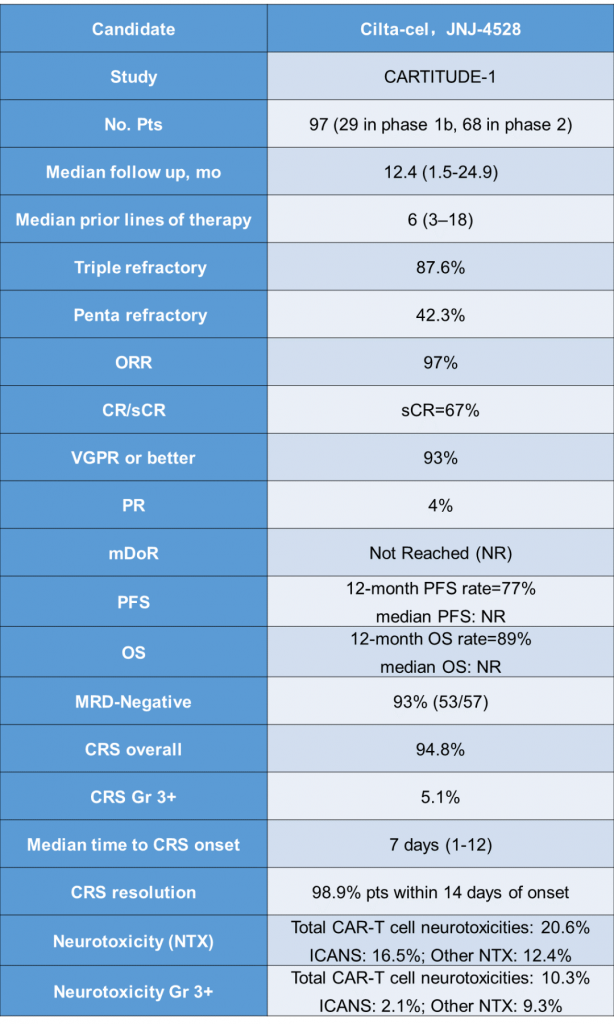
此次上市申请的提交是基于关键性的1b/2期CARTITUDE-1研究的结果。在第62届美国血液学学会(ASH)年会期间,CARTITUDE-1研究的最新数据显示,cilta-cel持续表现出非常高的总缓解率(ORR),在中位随访时间为12.4个月时,ORR达到97%,而且随着时间的推移,患者的缓解程度进一步加深,67%的患者达到严格的完全缓解。在中位随访时间为12.4个月时,患者的中位缓解持续时间和无进展生存期均尚未达到。
ASH 2020 CARTITUDE-1主要数据
传奇生物是一家全球性临床阶段生物制药公司,其目标是成为CAR-T和相关细胞疗法的全球领导者,治疗血液恶性肿瘤、实体肿瘤和传染病。2020年6月5日,传奇生物正式在美国纳斯达克敲钟上市,总募资金额超4亿美元。
cilta-cel则是传奇生物在研管线中进程最快的BCMA-CAR-T疗法。2017年12月,杨森公司针对cilta-cel项目向传奇生物支付3.5亿美元首期款及后续里程碑付款,该合作创下了当时中国药企对外专利授权首付款最大金额记录及合作最优条件。随后2018年,cilta-cel成为国内首个获批临床试验的CAR-T疗法,传奇生物也由此声名大噪。
这之后,cilta-cel更是一路开挂,不仅在2018年再次通过了美国FDA的IND批准,2019年其又先后获得FDA授予的孤儿药资格、EMA的优先药物审批资格,以及FDA突破性疗法认定。据悉,cilta-cel有望在2020年Q3向美国FDA提交BLA申请。
依据当时条款来看,目前有关cilta-cel临床开发的第五个里程碑已经达成,传奇生物有权就第五个里程碑获得由杨森生物支付的7,500万美元的里程碑付款。
而最新消息显示,传奇生物预计将于2021年初启动欧洲的MAA, 并且计划2021年向中国的CDE申报BLA。
值得一提的是。此前几乎就在传奇生物递交赴美上市申请的同一时间,FDA拒绝了BMS与bluebird(蓝鸟)共同开发的BCMA-CAR-T产品Ide-cel的上市申请,这款于此前3月份提交BLA的产品,一度被认为有望成为首款上市的BCMA CAR-T疗法。目前,该产品的上市申请已重新提交,并被授予优先审评资格。


文章评论(0)