天价抗癌药的生存悖论:价格飙升四倍,疗效提高了吗?
在当代医疗体系中,癌症药物正逐渐呈现出一个矛盾局面:一方面,它们以“突破性创新”之名密集上市,价格持续飙升;另一方面,FDA最新曝光的CRL文件显示,“临床证据不足”已成常见拒批理由之一。这种“天价定价”与“证据空洞”的撕裂,正成为癌症治疗领域最危险的病灶。
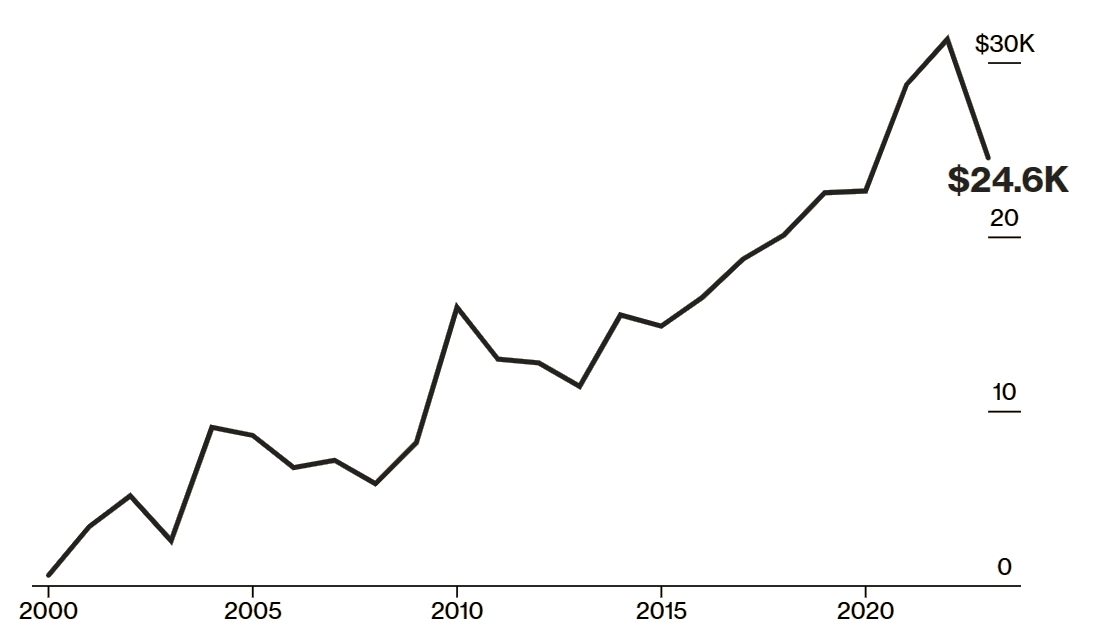
图1. 美国上市的新肿瘤药物月剂量初始价格中位数年度走势图。(图片来源:Bloomberg)
图1清晰地揭示出一个不容忽视的趋势:价格上涨远快于疗效验证的速度,而部分新药甚至尚未建立明确的临床获益基础。
尽管癌症新药的上市数量持续上升,然而其背后的临床证据基础却日益薄弱。2000年左右,FDA批准的癌症药物中位临床试验样本量接近800人,但到2020年,这一数字骤降(图2)。
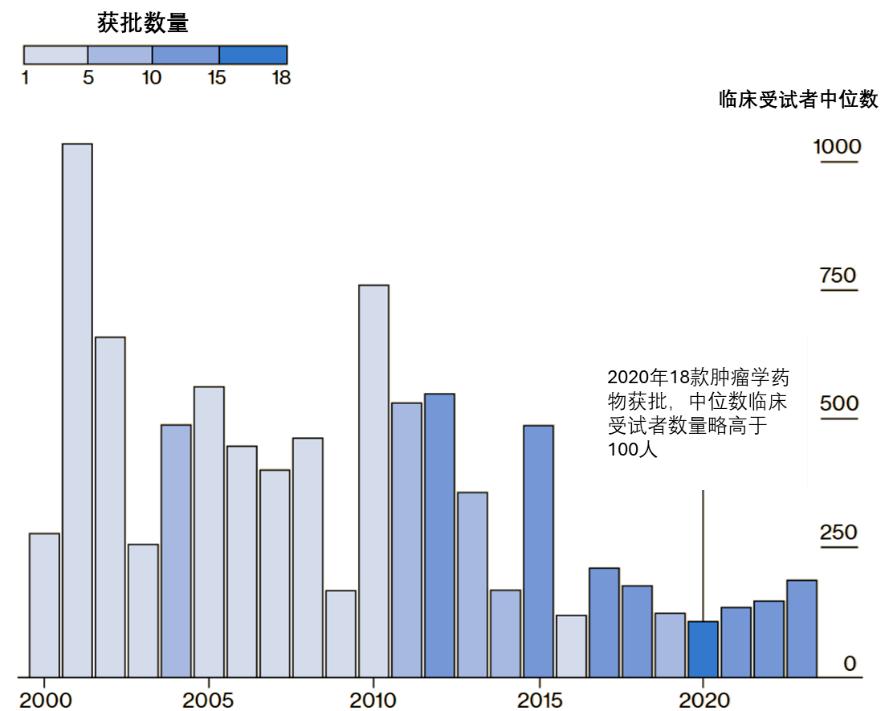
图2. 2000-2023年FDA批准肿瘤学产品的临床受试者人数中位数走势图。(图片来源:Bloomberg)
这一趋势揭示出:在快速审批机制推动下,药物上市所依赖的临床证据正变得越来越单薄。临床研究样本量不足,意味着试验结果的不确定性显著提高,而真实世界中患者的异质性更难被捕捉。这不仅削弱了疗效评估的外推力,也给医保支付和临床决策带来长期风险。
然而问题在于,这些审批加速机制大量依赖“替代终点”而非临床终点。例如2020年获批的18个癌症新药中,其中三分之二基于肿瘤缩小或无进展生存期(PFS),而非总生存期。这导致部分药物仅凭中期数据即获得市场通行证,真实疗效却仍未可知。
然而,随着使用范围的扩大,PFS所承载的临床意义却越来越受到质疑。一项发表于European Journal of Cancer的系统性回顾显示,1999–2015年间,约三分之二的新药在试验中达到了PFS延长目标,但最终只有38%的药物在后续研究中验证了总生存期(OS)改善。这一反差凸显出PFS与真实临床获益之间存在着不可忽视的显著脱节。
更关键的是,PFS反映的是“肿瘤未显著增长”的时间,而非“患者实际活得更久”,更不是“患者生活质量更高”。不少药物即便延缓了肿瘤进展,却伴随明显毒性,反而可能削弱患者的实际获益。在影像稳定的背后,病人可能正经历疼痛、乏力、恶心、脱发等多种副作用,而这些并不反映在PFS数据中。
从方法学上看,PFS还存在显著解释空间。例如“进展”的定义依赖扫描判断,易受到主观因素影响;扫描周期差异亦会影响测量结果。此外,由于PFS终点可在较短周期内达成,它被越来越多地用于满足加速审批、突破性疗法等监管快速通道的“达标工具”,而非真正反映药物长效价值的依据。
业内一直在争论的一个焦点是,当监管、市场与研发三方共同将PFS作为新药成败的评判标准时,是不是也在某种程度上忽视了癌症治疗最根本的两个目标,即延长生命和改善生活?PFS本可作为早期信号,但当它成为主要甚至唯一判断标准时,我们是否正在用效率取代效果?用量化数据掩盖患者真实的身体感受与生存质量?
如武田制药的多发性骨髓瘤治疗药物Ninlaro,其临床研究虽显示PFS延长,但目前尚无确凿证据表明其能延长生存期。
正如越来越多肿瘤学者指出的那样,PFS与OS的差异并非“统计细节”,而是涉及价值判断与伦理立场的核心分野。在以患者为中心的治疗体系中,单纯的肿瘤控制并不能等价于治疗成功。药物开发的真正价值,并不在于取代生存终点,而在于找到更科学、严谨且真正反映患者获益的评估方式。延长生存始终是癌症治疗的重要目标,但如果用于审批的替代终点与这一目标脱节,甚至误导临床判断与资源配置,那便可能南辕北辙。唯有在替代终点选择上更加严谨,强化对总生存期与生活质量的长期验证,人们才能真正衡量一款药物是否值得信赖,以及是否其价格存在“德不配位”的问题。
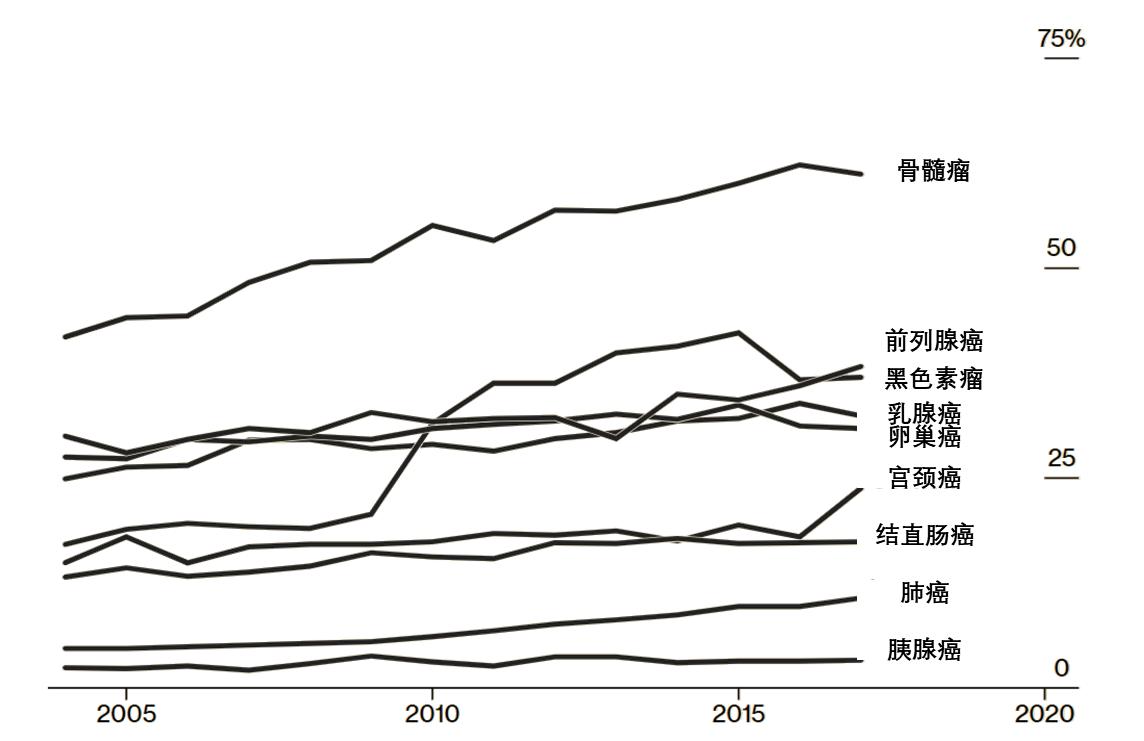
图3. 癌症晚期的五年相对生存率数据随时间变化图。(图片来源:Bloomberg)
而从医保体系来看,面对“高价药物持续涌入,疗效证据参差不齐”的格局,不少国家已开始强化“基于价值的支付机制”(Value-Based Pricing),即将药物报销标准与真实世界疗效表现挂钩。例如英国NICE便多次对PFS无明确转化为OS的药物提出再评估,德国与荷兰也逐步推行医保谈判与动态调价机制。
然而,在缺乏充分随访数据与量化标准的现状下,“按疗效付费”的落实难度极大。更复杂的是,当患者别无选择时,即便知道某些药物疗效不明,也只能“无奈接受”。这让本应公平、透明的支付机制陷入两难。
更值得关注的是,部分制药公司已逐步将高价药物向“自我给药”方向转化,意图绕开医院体系、改由门诊或患者家庭使用,以转嫁成本、规避价格管制。虽然提高了便利性,但也引发了新一轮公平性与可负担性的争议。
正因如此,未来如何在疗效确认机制尚不完善的前提下,建立兼顾效率、公正与可持续的支付体系,将成为癌症药物领域绕不开的重大议题。
一些药物上市多年,依然没有提交其关键适应症下的总生存期数据。而监管部门在追踪这些“补充研究”的合规性方面,也缺乏强制执行力。药物获批容易,但退市极难,这也让患者与医保体系长年承担不确定的成本与风险。
加速审批的出发点本身并不构成问题的核心,也并非否定替代终点的合理性,而是强调其使用边界。当“缩瘤”成为替代“延命”的主流标准,临床终点的科学性与伦理性就正在被重新书写。而一旦价值评估脱离真实生存获益,癌症治疗将不可避免地滑向“效率优先”的空转陷阱。
破解之道,必须从三个层面协同推进:
- 在监管层面,强化加速审批药物的后续疗效验证义务;
- 在支付层面,推动基于疗效的动态定价机制;
- 在研发层面,重建以“总生存期+生活质量”为核心的评价体系。
唯有将疗效验证与支付激励重新绑定,将科学审慎与患者体验置于决策中心,我们才能让癌症药物真正回归其应有的使命:帮助患者活得更久,活得更好,而不是付出更多却得到更少。
Ref.
Langreth, R. et al. Cancer Drugs Cost More Than Ever. They Often Don’t Extend Lives. Bloomberg. 28. 05. 2025.
Pasalic, D. et al. Progression-free survival is a suboptimal predictor for overall survival among metastatic solid tumour clinical trials. European Journal of Cancer. (2020) 136, 176–185.
Temkin, E. et al. FDA’s Accelerated approval pathway: a rare disease perspective. History and Opportunities for Reform. National Organization for Rare Disorders. 2021.
Langreth, R. Expensive Cancer Drugs Don't Always Work. Bloomberg. 30. 05. 2025.



文章评论(0)