国内首个RET抑制剂,基石药业普拉替尼附条件获批!
3月24日,国家药品监督管理局(NMPA)通过优先审评审批程序附条件批准基石药业普拉替尼胶囊以商品名普吉华上市,用于既往接受过含铂化疗的转染重排(RET)基因融合阳性的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者。这是国内获批的首个RET抑制剂。
这也意味着基石药业在IPO两年后终于迎来了首个商业化产品。
截图自NMPA
据悉,此次获批基于一项名为ARROW的关键I/II期研究结果,数据显示普拉替尼在多种晚期RET变异实体肿瘤(包含RET融合阳性NSCLC)中具有广泛和持久的抗肿瘤活性。在87例既往接受过含铂化疗的患者中,普拉替尼治疗组患者的客观缓释率(ORR)为57%,完全缓解率(CR)为5.7%。在27例不适合接受含铂化疗的初治患者中,ORR为70%,CR为11%。此外,在来自10个中国研究中心的37例晚期RET融合阳性NSCLC患者中,32例患者的ORR为56%。
基石药业是一家生物制药公司,成立于2015年底。截止目前,基石药业已经完成超4亿美元的两轮融资,并于2019年2月在港交所挂牌,成为在港交所上市的第六家未盈利企业。一直以来,基石药业以肿瘤免疫治疗联合疗法为核心,建立了一条由14种肿瘤候选药物组成的丰富产品管线,其中6款后期候选药物正处于关键性临床试验或注册阶段。
此次获批的普拉替尼是基石药业首个商业化产品。
普拉替尼由基石药业战略合作伙伴Blueprint Medicines Corporation(Blueprint)开发的一款每日口服一次、强效、高选择性靶向致癌性RET变异(包含可预见的耐药突变)药物。2018年6月,基石药业通过与Blueprint 签订独家合作及授权许可协议,获得普拉替尼单药或联合治疗在大中华地区(包括中国大陆、香港、澳门和台湾地区)的临床开发与商业化权利。
早在2020年9月,普拉替尼(Pralsetinib)就获得FDA批准,用于治疗RET融合阳性的局部晚期或转移性NSCLC成人患者;与此同时,NMPA也受理了普拉替尼的新药上市申请并纳入优先评审。12月1日,普拉替尼又获得FDA批准用于需要全身治疗的12岁以上儿童及成人晚期或转移性RET突变甲状腺髓样癌(MTC),以及需要全身治疗且放射性碘难治的12岁及以上儿童及成人晚期或转移性RET融合阳性MTC。
在临床前研究中,普拉替尼针对最常见RET基因融合、激活突变及预测耐药突变始终表现出次纳摩尔水平的效价。相比VEGFR2,普拉替尼对RET的选择性可提高80倍。此外,普拉替尼对RET的选择性与已批准的多激酶抑制剂效果相比有显著提高。通过抑制原发和继发突变,普拉替尼有望克服和预防临床耐药的发生。这一疗法预期可以在携带不同RET变异的患者中实现持久的临床缓解,且具有良好的安全性。
其中,RET激活型融合和突变是许多癌症类型的关键驱动因素,如NSCLC和MTC。约1-2%的NSCLC患者、10-20%的甲状腺乳头状癌(PTC)患者以及90%的晚期MTC患者均涉及RET融合。此外,在结直肠癌、乳腺癌、胰腺癌和其他癌症中,也观察到低频率的RET突变,在耐药、EGFR突变的NSCLC患者中也观察到RET融合。
值得一提的是,2020年5月,FDA批准礼来RET激酶抑制剂Retevmo,用于治疗肿瘤中RET基因存在基因突变或融合的NSCLC患者,成为首个获批的药物用于携带RET基因改变的癌症患者。不过普拉替尼与其相比,存在每日口服1次达到治疗效果的优势。
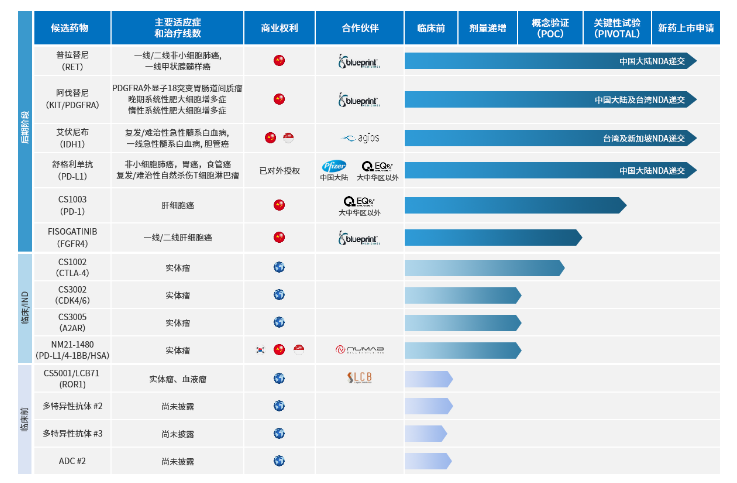
普拉替尼在国内上市只是第一步,从基石药业官网来看,其3款肿瘤免疫治疗骨干产品均已进入临床研发阶段。此外,4款具有大中华区开发及商业权的产品中,有2款是全球同类首款产品,另外2款候选药物具有同类首款潜力。预计在2022年至2025年将有超过6个潜在获批产品,覆盖 14个以上适应症。
截图自基石药业官网
“2021年会是基石药业的发展大年,公司正在为产品商业化做充分准备。”基石药业董事长江宁军在一次采访中表示,这也意味着基石药业将完成从生物技术公司向生物制药公司的升级。
截止目前,基石药业的肿瘤免疫疗法药物舒格利单抗以及精准治疗药物阿泊替尼、艾伏尼布也已经完成NDA递交,预计今年上市。
舒格利单抗是一种全人源全长抗PD-L1单克隆抗体,也是一种最接近人体的天然G型免疫球蛋白4(IgG4)单抗药物。舒格利单抗在患者体内产生免疫原性及相关毒性的风险更低,具有成为同类最优免疫检查点抑制剂的潜力。
2020年10月,舒格利单抗获得FDA授予的单药治疗成人复发或难治性结外自然杀伤细胞/T细胞淋巴瘤(R/R ENKTL)突破性疗法认定以及治疗T细胞淋巴瘤的孤儿药资格认定。
在2020年CSCO会议上,基石药业对舒格利单抗单药治疗R/R ENKTL患者的CS1001-201研究进行了口头汇报。数据显示,在38例疗效可评估患者中,客观缓解率为44.7%,完全缓解率为31.6%,中位缓解持续时间(mDoR)为16.8个月。
此外,舒格利单抗正针对多个癌种开展一项多臂Ib期临床试验,一项针对淋巴瘤的II期注册临床试验,以及四项分别在III期、IV期非小细胞肺癌、胃癌和食管癌的III期注册临床试验。其中舒格利单抗治疗IV期非小细胞肺癌患者的III期临床试验达到主要终点。2020年11月,NMPA已受理舒格利单抗用于一线治疗非小细胞肺癌的新药上市申请。
阿泊替尼(Avapritinib)是一款强效、高选择性的、在研口服针对KIT和PDGFRA基因突变的抑制剂,由基石药业的合作伙伴Blueprint开发。已公布的NAVIGATOR研究数据显示,阿泊替尼在PDGFRA外显子18突变(包括D842V突变)的晚期GIST患者中,总缓解率(ORR)达 86%,四线治疗的GIST患者中,ORR达22%。
2020年1月,阿泊替尼获得FDA批准上市,用于治疗携带PDGFRA外显子18突变(包括PDGFRA D842V突变)的不可切除或转移性胃肠道间质瘤(GIST)成人患者。随后欧盟委员会也批准阿泊替尼以商品名AYVAKYT上市销售。此外,FDA也授予了阿泊替尼突破性疗法认定,用于治疗中重度惰性系统性肥大细胞增多症(SM)。
阿泊替尼是全球首个适用于治疗基因组定义的GIST患者的精准治疗药物,也是唯一一个针对携带PDGFRA基因18号外显子突变GIST患者的高活性疗法。目前已成功入选2020版《CSCO 胃肠间质瘤诊疗指南》。
3月18日,NMPA官网显示阿泊替尼的新药上市申请审评审批状态已更新为:在审批,用于治疗携带血小板衍生生长因子受体α(PDGFRA)外显子18突变(包括PDGFRA D842V突变)的不可手术切除或转移性GIST成人患者,以及四线不可手术切除或转移性GIST成人患者。该药物有望成为国内首个获批的针对PDGFRA外显子18突变型GIST的精准治疗药物。
近期,基石药业与国药控股股份有限公司(国药控股)签署战略合作协议,旨在通过各自在医药创新、市场开拓与渠道管理方面的优势,携手推进精准治疗药物阿泊替尼(Avapritnib) 和普拉替尼(Pralsetinib)在国内获批上市后的商业化进程。而与国药控股战略合作是基石药业加速布局,实现创新药物阿泊替尼和普拉替尼商业化的重要举措之一。
艾伏尼布(Ivosidenib)是一种强效、高选择性同类首创口服IDH1抑制剂,由基石药业的合作伙伴Agios Pharmaceuticals(Agios)开发,且已于2018年7月获得FDA批准上市,用于治疗经FDA批准的伴随诊断检测的携带易感IDH1基因突变的急性髓系白血病(AML)成人患者。2019年5月,FDA批准了艾伏尼布的补充新药申请,用于治疗75岁及以上、因其他合并症而无法使用强化化疗的新诊断IDH1基因突变的AML患者。
目前,艾伏尼布是全球首个且唯一一个获得FDA批准治疗携带易感异柠檬酸脱氢酶-1(IDH1)突变的成人复发或难治性急性髓系白血病(R/R AML)药物。而基石药业通过与Agios签订合作协议,获得在大中华地区及新加坡的临床开发和商业化艾伏尼布的独家授权。2020年11月,基石药业已向新加坡提交艾伏尼布的新药上市申请,用于治疗R/R AML患者。
此外,艾伏尼布也入选2020版《CSCO 恶性血液病诊疗指南》,并被列入国家药品监督管理局药品审评中心发布的“临床急需境外新药名单(第三批)”。
商业化箭在弦上的同时,基石药业也在不断地加强合作,拓展更广阔的市场。根据贝壳社不完全梳理,2020年基石药业相继与辉瑞、EQRx及LegoChem Biosciences达成合作,除了为现有产品的商业化和全球化布局打好基础,还在不断扩充产品管线以面对更过阔的肿瘤市场。
2020年10月,与EQRx公司就两款肿瘤免疫治疗药物舒格利单抗和CS1003(抗PD-1单抗)达成全球战略合作。基石药业获得1.5亿美元的首付款,及最高可达11.5亿美元的里程碑付款和额外的分级特许权使用费。而EQRx拥有创新的商业模式,将助力这两款药物在目标适应症上相对于现有疗法寻找具备全球市场的竞争优势。
2020年10月,与LegoChem Biosciences达成新型抗体偶联药物全球授权协议,将获得在韩国以外全球地区开发和商业化ROR1抗体偶联药物LCB71的独家授权,LCB71是一款以受体酪氨酸激酶样孤儿受体1(ROR1)为靶点的临床前抗体偶联药物,在多种癌症中都有高表达,包括各类白血病、非霍奇金淋巴瘤、乳腺癌、肺癌及卵巢癌。
此外,基石药业也建立了一支近200人的商业团队,其中管理人员均有超20年以上的肿瘤领域经验,科学顾问委员会的成员更是具备丰富的肿瘤及免疫肿瘤经验。
一系列合作和布局的背后,显示出基石药业对肿瘤市场的志在必得,伴随着产品的逐步上市和商业化,基石药业或将迎来业绩的大爆发。


文章评论(0)