阿尔茨海默症“年轻化”,至今束手无策?
多年来,全球药企投入了巨大的经费进行阿尔茨海默症药物的研发,但大部分以失败告终,研发之路仍长路漫漫。
对于阿尔茨海默症症的研究迄今已过百年,但依然未取得突破性进展。
根据国际阿尔茨海默症协会的数据显示,全球大约有5000万阿尔茨海默症患者,其中近60%生活在低收入和中等收入国家,预计到2030年全球患者总数将达8200万,到2050年将达1.52亿;我国每年至少有30万新发病例,目前患者数已超过1000万,占全球阿尔茨海默症患者总人数的25%,这一数字还在随着人口老龄化不断攀升。

来源:https://www.sohu.com/a/367560276_466445
因此,阿尔茨海默症治疗药物存在巨大且急迫的需求。
阿尔茨海默症的发病机制复杂,至今仍未完全破译具体机制,目前主流认可度较高的发病机制主要有两个假说:脑内细胞外β-淀粉样蛋白(Aβ)逐渐沉积和细胞内Tau蛋白聚集导致的神经元死亡和认知障碍。
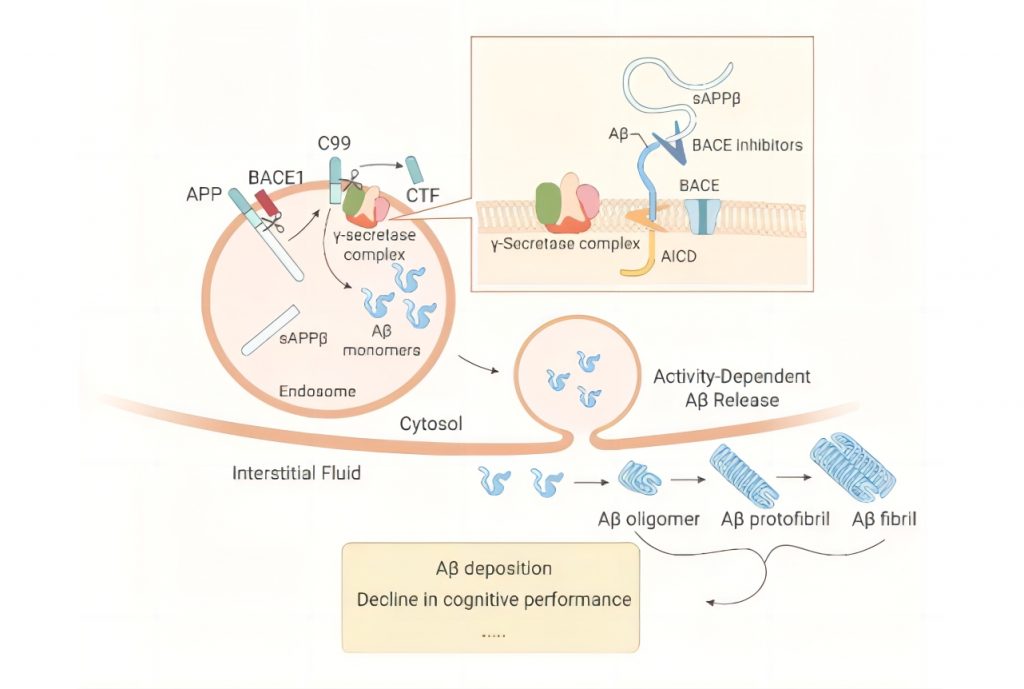
Aβ蛋白沉积,来源:MedChemExpress
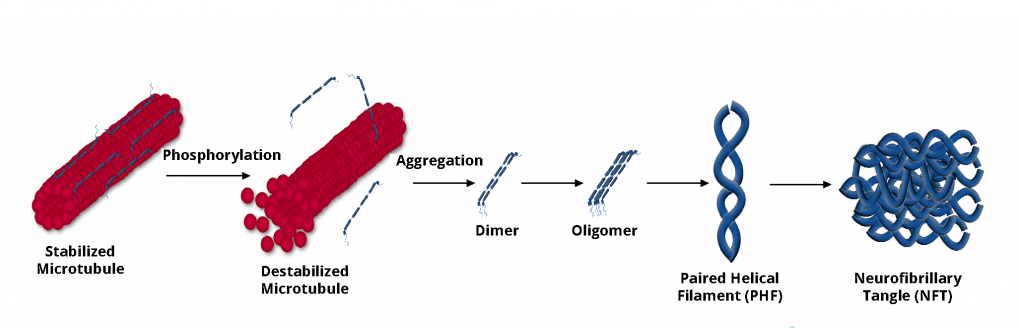
tau蛋白聚集过程,
来源:http://www.neobioscience.com/xwzx_1795.html
除了以上两个假说,还存在胆碱能神经元假说、胰岛素假说、自由基损伤假说等,但目前单一的假说并不能解释阿尔茨海默症的全部发病特征。
在近期,又有两项关于阿尔茨海默症发病机制的重磅研究被发表,一是来自我国西湖大学施一公团队进一步揭示了APOE4可能是阿尔兹海默症最大的风险基因,该成果发布在《细胞研究》期刊上;二是麻省理工的研究团队发现APOE4基因会导致隔离神经纤维的脂质失调,进而影响神经元连接性,该成果发布在《Nature》上。
正是由于发病机制的不明确,现阶段药物研发大部分转为开发基于各种假说理论的对因治疗药物,包括AChE(乙酰胆碱酯酶)抑制剂、β淀粉样蛋白拮抗剂、淀粉样蛋白沉淀抑制剂、β淀粉样蛋白合成抑制剂、Tau蛋白抑制剂、Tau蛋白聚集抑制剂、NMDA(N-甲基-D-天冬氨酸)受体拮抗剂、BuChE(丁酰胆碱酯酶)抑制剂等。
同样,也是由于发病机制的不明确,阿尔茨海默症药物的研发屡战屡败,研发的失败率高达99.6%。
直到2021年6月,美国FDA批准了Aducanumab的上市,才终结了2003年之后未有阿尔茨海默症治疗药物获批的尴尬处境。
但是,这款药物的上市却引起了很大的争议。
2007年,渤健(Biogen)从Neurimmune公司获得该药的开发和营销权。同年,渤健与卫材(Eisai)达成合作,共同开发和商业化Aducanumab;2019年3月,在两项临床试验ENGAGE和EMERGE研究因独立委员会评估,该药不太可能改善阿尔茨海默症患者认知功能而提前终止;2019年10月,渤健经过对这两项研究更大数据集分析发现,此前对Aducanumab无效性分析的假设是不成立的。
于是,2020年8月,渤健向美国FDA重新提交了上市申请,并被纳入优先审评通道。
但是在之后的2020年11月美国FDA针对Aducanumab召开的专家咨询会上,11位专家对于临床数据能否支持有效性的问题几乎都投了反对票。其中三名成员——Caleb Alexander、Scott Emerson和Aaron Kesselheim还在JAMA的一篇文章中发表了他们对Aducanumab的反对意见。
2021年6月,美国FDA未遵循专家顾问委员会的意见,仍然坚持批准上市,这也导致了其中一些专家以辞职方式表达抗议。

来源:《JAMA》杂志
在中国,同样也有一款饱受争议的阿尔茨海默症治疗药物——甘露特纳(商品名:九期一)。
2019年11月,国家药监局有条件批准中国海洋大学、中科院上海药物所与上海绿谷研发的甘露特纳用于治疗轻度至中度阿尔茨海默症症。此举引发了业内多种争议:一方面是有条件批准下仅完成了II期临床,较短的观察期能否证明持续疗效;另一方面在作用机制上,甘露特纳是全球首个靶向脑-肠轴的阿尔茨海默症治疗药物,通过重塑肠道菌群平衡,抑制菌群特定代谢产物异常增多,减少外周及中枢炎症,从而改善认知功能障碍,而这并非业界认为的阿尔茨海默症主流病因。

来源:上海绿谷制药官网
拿不出足够的临床试验证据是上述两款获批药物被质疑的主要原因。
不过很快,另一款药物就拿出来足够的临床试验数据。
在Aducanumab获批之后,渤健和卫材又联合宣布,美国FDA授予其针对Aβ的另一款在研抗体Lecanemab(BAN2401)突破性疗法认定。虽然同为Aβ单抗,Lecanemab就顺利得多,主要是由于Lecanemab相比Aducanumab效果明确,且有充分的临床数据。
2022年11月,Lecanemab的III期试验的详细临床数据在第15届阿尔茨海默症临床试验(CTAD)会议上被公开。该试验历时18个月,一半志愿者每两周注射一次Lecanemab,而另一半则服用安慰剂。结果显示,服用Lecanemab的患者记忆力和思维敏捷度下降速度减慢了27%。
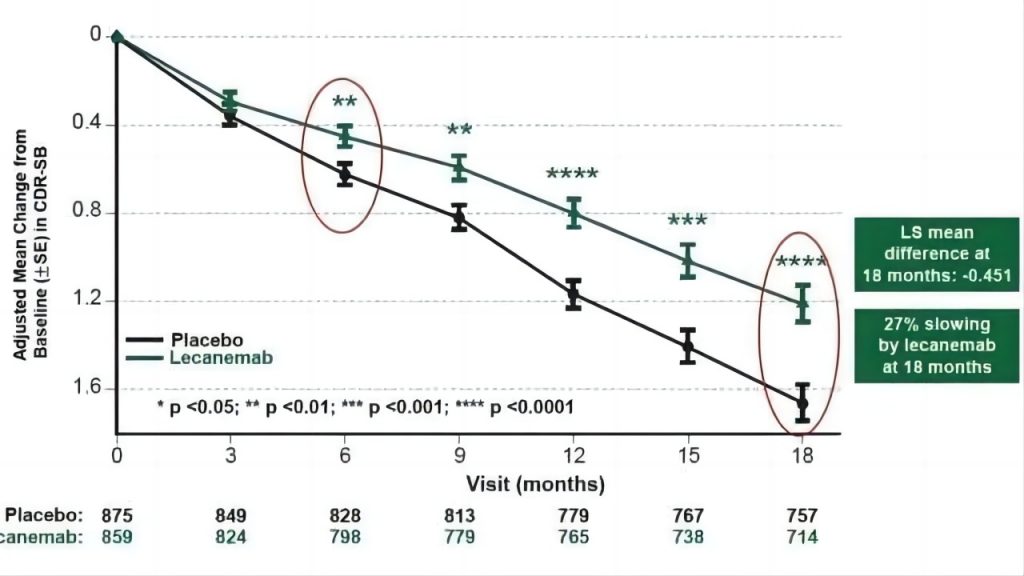
Lecanemab相关临床数据,来源:渤健官网
这个结论大大提振了人们对该药成功的信心,该药也被视为人类距离攻破老年痴呆症最近的一次尝试。但是伴随着这样疗效的是令人担忧的安全性:实验组患者有17.3%有脑部出血迹象、12.6%出现脑水肿,对照组患者仅有9%脑部出血、1.7%脑水肿。
实际上,关于Lecanemab的安全性,业界一致持怀疑态度,已经有多个死亡病例疑似与该药有关。
不过这并未影响Lecanemab的顺利获批,2023年1月Lecanemab的PDUFA(处方药用户费用法案)正式生效,成为全球第2款获批上市的Aβ单抗。这也使得Aβ单抗研发路线大受鼓舞。
据药渡数据显示,截至目前,已有1066项与阿尔茨海默症有关的在研项目完成或正在进行中;其中,处于临床III期有37个在研项目。
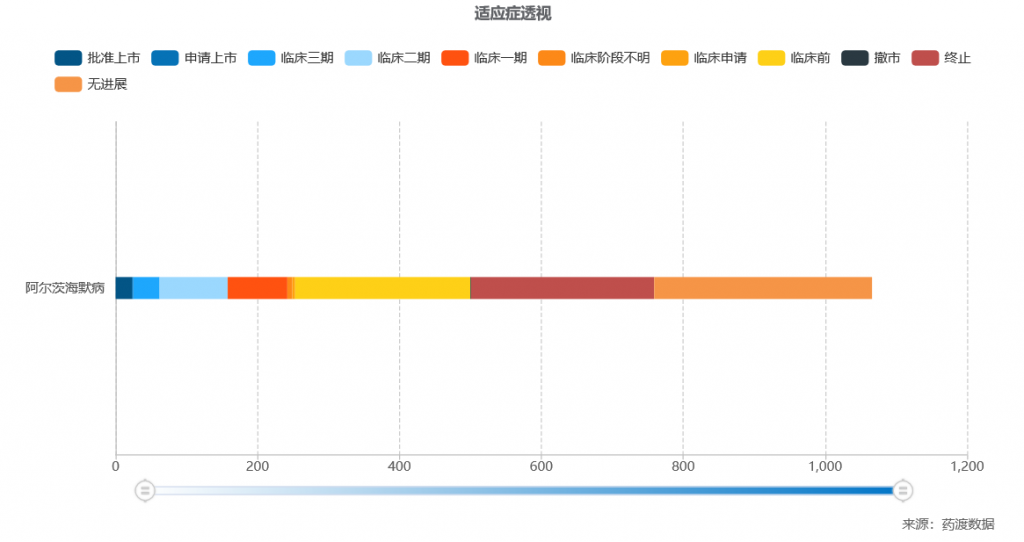
阿尔茨海默症有关的在研项目情况,来源:药渡数据
在Aβ单抗研发路线除了上述已获批的两款单抗,还包括礼来的Donanemab和罗氏的Gantenerumab也备受关注。
2022年11月,礼来宣布其Donanemab治疗早期阿尔茨海默症III期研究TRAILblazer-ALZ 4在6个月分析中达到所有主要和次要终点,这是一项Donanemab和Aducanumab的头对头研究。
在治疗6个月后,Donanemab和Aducanumab组达到淀粉样蛋白斑块完全清除(定义为淀粉样蛋白等级<24.1CL)的患者比例分别为37.9%和1.6%,淀粉样蛋白斑块水平分别比基线水平降低了65.2%和17%。
Donanemab是一种靶向被称为N3pG的修饰化β淀粉样蛋白斑块的在研抗体药物。2021年6月,基于其II期临床数据,美国FDA授予该药治疗阿尔茨海默症的突破性疗法认定。不过在今年1月,美国FDA拒绝了礼来加速批准Donanemab的申请,原因是该公司没有提交足够的接受了至少一年治疗的病人的试验数据。
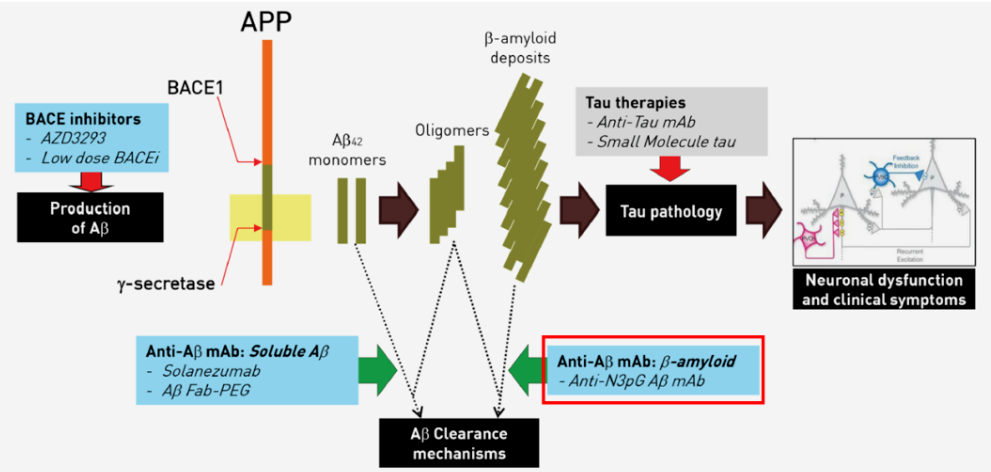
Donanemab作用机制,
来源:https://www.vodjk.com/news/210625/1682958.shtml
同样是去年11月,罗氏公布了其皮下注射Aβ单抗Gantenerumab针对早期阿尔茨海默症患者两项III期GRADUATE研究的结果。数据显示,这两项研究没有达到改善认知损伤临床的主要终点,该药清除β-淀粉样蛋白的水平低于预期。
值得注意的是,Gantenerumab曾在2014年的关键试验中失败,在2020年的另一项关于家族性阿尔茨海默症的研究中失败,尽管成功降低了淀粉样蛋白水平。不过,罗氏认为,2014年的研究中产品剂量过低,因此启动了两项III期试验,其剂量是前者的四倍。
此番再次受挫,Gantenerumab的前景也再度黯淡。
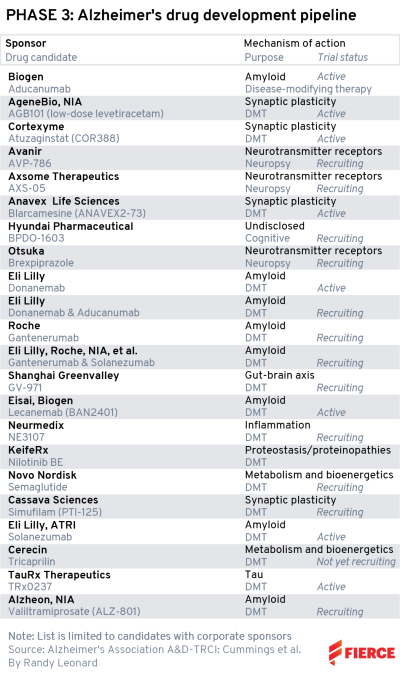
全球进入临床III期的阿尔茨海默症研发管线
来源:参考资料4
事实上,除了Aβ单抗研发路线,其他研发路线也在不断取得进展。这其中活跃着许多国内药企的身影:
Semorinemab是一种人源化的抗tau IgG4单克隆抗体,由基因泰克开发;
Atuzaginstat是一款牙龈菌蛋白酶(gingipain)抑制剂,可以降低牙龈卟啉单胞菌毒性,降低细菌负荷,从而改善阿尔茨海默症进展;
ATH-1017是一种小分子药物,旨在增强肝细胞生长因子在其受体MET上的活性,由Athira Pharma开发;
AGB101是一款低剂量的抗癫痫药物,使早期阿尔茨海默症患者海马回出现神经过度活跃的情况减弱,由AgeneBio开发等;
Protollin是第一个被用于预防阿尔茨海默症的鼻腔疫苗,由天境生物和恩华药业License-in等。
目前,除了靶向病理蛋白Aβ和Tau两条研发路线之外,越来越多的项目走了另外的路线,一个竞合时代即将到来。
参考资料:
1、各大上市公司官网、年报等
2、《阿尔茨海默症药物研发历程回顾及最新进展》,药渡经纬,2022-2-4
3、《阿尔茨海默病千亿市场终破局:不同的药物,相似的争议》,新康界,2021-6-12
4、《2022,阿尔茨海默病的研发管线正在突飞猛进!》,药时空,2022-9-3
5、《2021年度阿尔兹海默症(AD)新药研发进展梳理》,求实药社,2021-12-16


文章评论(0)