肿瘤克星:免疫细胞疗法的发展概况与趋势(下)丨贝研报 04
不过,中国科学家赵洁突破了这个局限性,研发出了超级TIL疗法。相比传统的TIL免疫细胞疗法,它多了个在体外将基因改造成能攻克肿瘤环境障碍,而且无限复制的环节,未来有望在实体瘤领域“大放异彩”。
NK细胞源自胎盘,可以识别健康细胞和肿瘤细胞,不需要MHC分子进行抗原递呈和抗原激活,可以靶向多种致病性抗原,具有更强的细胞毒性。
在18个中国正在进行的NK细胞疗法相关的研发中,除药明巨诺计划引进的Acepodia的两个NK细胞联合单克隆抗体的疗法外, NK细胞疗法相关企业全部集中于CAR-NK的研发,然而靶点较CAR-T疗法来说更为分散,同时,适应症方面也不局限于血液瘤,而是在实体瘤中有了更多的尝试。
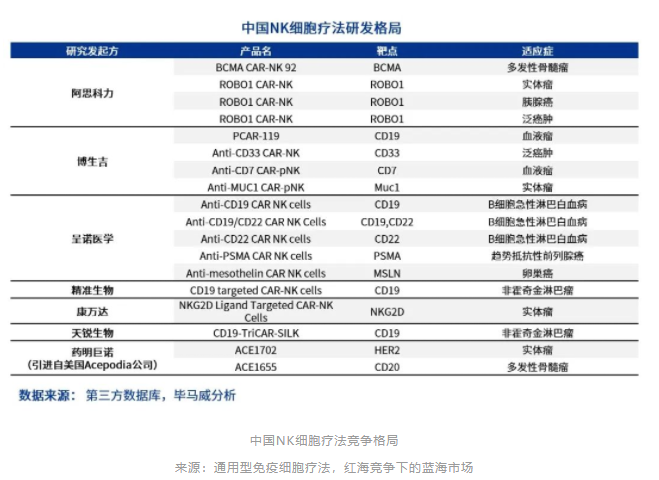 NK细胞是人体的第一道免疫防线,天然地具有抗肿瘤和抗病毒的作用。相对T细胞而言,NK细胞对于肿瘤的杀伤力相对更低,然而异体输入的NK细胞不会引起移植物抗宿主病,移植物抗宿主病恰恰是通用型CAR-T技术中最大的难点之一。从这个角度来说,NK细胞展示了其作为异体输入的免疫细胞的潜力所在。NK细胞分泌的细胞因子和趋化因子还可以激活其它免疫细胞对肿瘤细胞的杀伤作用,起到免疫系统调控的作用。
NK细胞是人体的第一道免疫防线,天然地具有抗肿瘤和抗病毒的作用。相对T细胞而言,NK细胞对于肿瘤的杀伤力相对更低,然而异体输入的NK细胞不会引起移植物抗宿主病,移植物抗宿主病恰恰是通用型CAR-T技术中最大的难点之一。从这个角度来说,NK细胞展示了其作为异体输入的免疫细胞的潜力所在。NK细胞分泌的细胞因子和趋化因子还可以激活其它免疫细胞对肿瘤细胞的杀伤作用,起到免疫系统调控的作用。
此外,NK细胞相较T细胞而言,PD-1的表达相对更低,因此在实体瘤的肿瘤微环境中受到的免疫抑制更低;其天然的非特异性也一定程度地解决了实体瘤中肿瘤细胞异质性的问题,有望成为攻克实体瘤的细胞疗法。
在中国,NK免疫细胞疗法的费用在5—10万元,目前尚在临床研究阶段。虽然该疗法存在免疫检查点的激活或抑制机制,但是不会像CAR-T细胞引发细胞因子释放综合征那样严重的不良反应,而且无论是对抗实体瘤,还是针对血液癌症,NK细胞都向人们展现了具有前景的一面。
2022年1月25日,FDA批准Kimmtrak(tebentafusp-tebn,IMCgp100)用于 HLA-A*02:01 阳性的无法切除或转移性葡萄膜黑色素瘤(mUM)成人患者。这是一种双特异性 gp100 肽-HLA 导向的CD3-T细胞接合剂,成为全球首个上市的TCR-T疗法,也是唯一一个获得FDA批准治疗不可切除性或转移性mUM的疗法。
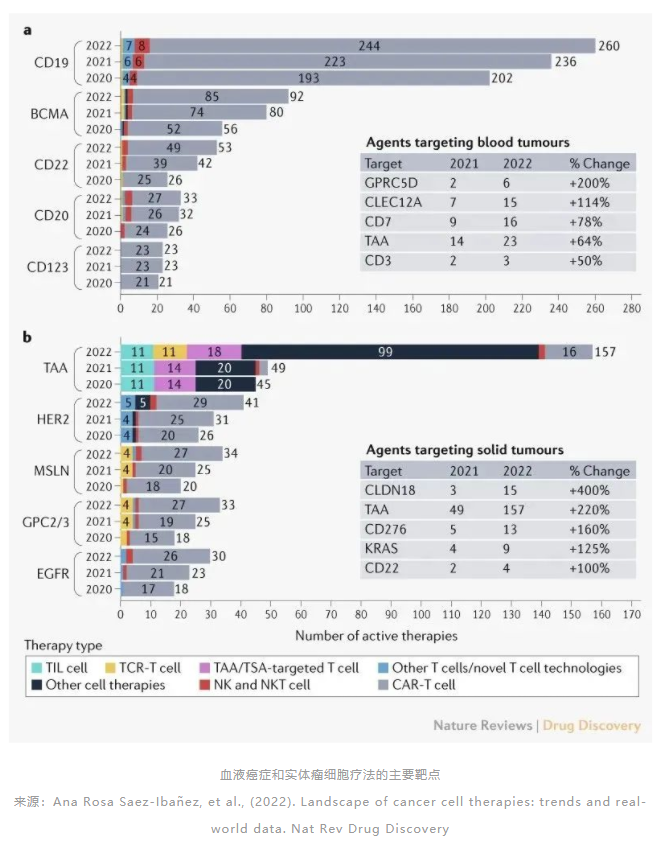
据Cortellis数据库显示,全球处于临床前及以上研究阶段的药物共有117个,其中临床前61个、临床1期30个、临床2期23个。全球在研的TCR-T项目中,70%以上适应症为实体瘤,主要包括转移性非小细胞肺癌、肝细胞癌、多发性骨髓瘤、软组织肉瘤、头颈癌、黑色素瘤、脂肪肉瘤和宫颈癌等。从靶点来看,癌-睾丸(CT)抗原依然是研发热点,靶向NY-ESO-1的项目数量位居前列。
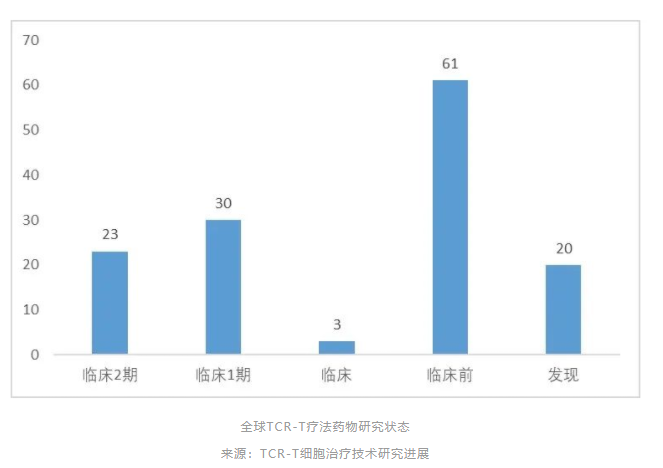 目前TCR-T疗法进展较快的主要有Adaptimmune Therapeutics的 ADP-A2M4CD8、Kite Pharma (Gilead Sciences)的 NY-ESO-1 TCR、华夏英泰的 YT-E001等,均处在II期临床研究阶段。
目前TCR-T疗法进展较快的主要有Adaptimmune Therapeutics的 ADP-A2M4CD8、Kite Pharma (Gilead Sciences)的 NY-ESO-1 TCR、华夏英泰的 YT-E001等,均处在II期临床研究阶段。
目前,国内肿瘤新发人数持续增高,根据中国TCR-T疗法的潜在需求预测,2021—2025年,中国TCR-T疗法行业市场规模从387.0亿元增长至1041.4亿元,年复合增长率达到28.1%。
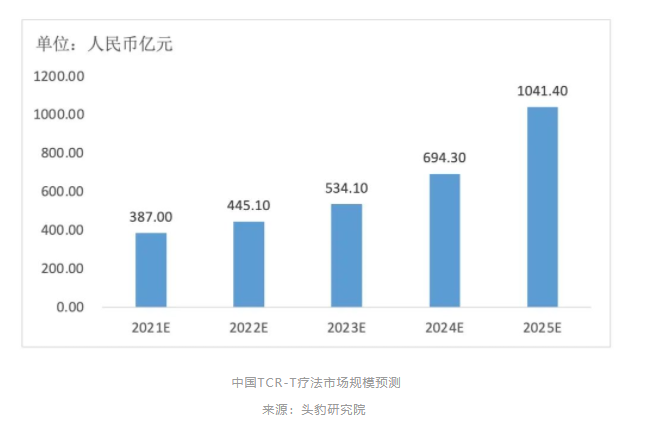 同时,TCR-T疗法具有能够识别细胞内外肿瘤特异性抗原、靶向实体瘤效果更明显,在人体存留时间更长等优势,预计将进一步推动TCR-T疗法市场增长。
同时,TCR-T疗法具有能够识别细胞内外肿瘤特异性抗原、靶向实体瘤效果更明显,在人体存留时间更长等优势,预计将进一步推动TCR-T疗法市场增长。
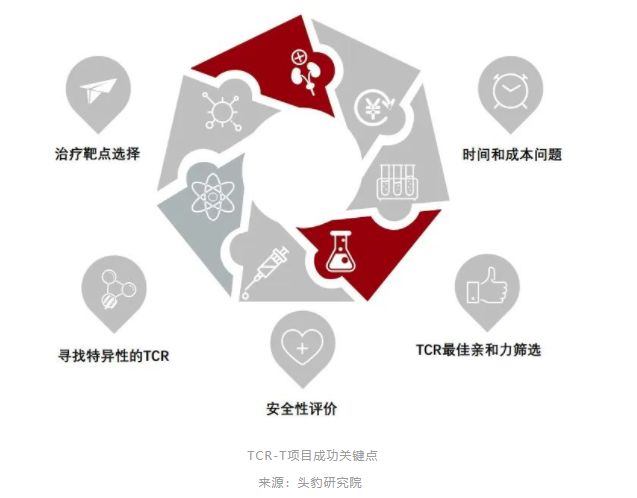 此外,TCR必须与患者的人类白细胞抗原(HLA)等位基因相匹配才能识别pMHC(抗原肽-MHC分子复合物)并杀伤癌细胞,所以筛选合适的HLA配型也非常重要,这也是为什么国外的TCR-T不能直接在国内应用的原因之一。
此外,TCR必须与患者的人类白细胞抗原(HLA)等位基因相匹配才能识别pMHC(抗原肽-MHC分子复合物)并杀伤癌细胞,所以筛选合适的HLA配型也非常重要,这也是为什么国外的TCR-T不能直接在国内应用的原因之一。
此后,药监局每年都会出台相应政策,譬如2018年的《细胞治疗产品申请临床试验药学研究和申报资料的考虑要点》、2019年的《细胞治疗产品申报临床试验药学研究问题与解答》、2020年的《免疫细胞治疗产品药学研究与评价技术指导原则(征求意见稿)》、2022年的《药品生产质量管理规范-细胞治疗产品附录(征求意见稿)》等同类政策。
但是,随着时间推移和行业发展,细胞治疗行业急需更加明确和具体的法规。因此,2022年6月颁布的《免疫细胞治疗产品药学研究与评价技术指导原则(试行)》(简称指导原则),无疑是国家局在细胞治疗药学领域的政策细化中做出的一大实质性举措。
该指导原则首次明确提出了细胞治疗产品应“遵循药品研发的一般规律、考虑产品的特殊性”这一理念,在承认特殊性的前提下、强调GMP等一般规律仍居于核心地位。这也提醒业内公司在进行注册申报工作的时候,不应过度强调或依赖CAR-T类产品的特殊性。
并明确的给出了CAR-T类产品风险评估的五大要点,具体包括:
生产过程:具体两个方面,第一是生产过程是开放、半密闭或全密闭,第二是混淆/污染/交叉污染(这三兄弟是老话题了,CDE在所有CAR-T药学指导原则中均反复提及);
质量研究:主要是质控方法的选择,例如支原体的药典法与快检法、RCL的细胞培养法与qPCR法;
贮存条件和容器:是否有进行贮存稳定性和包材相容性研究

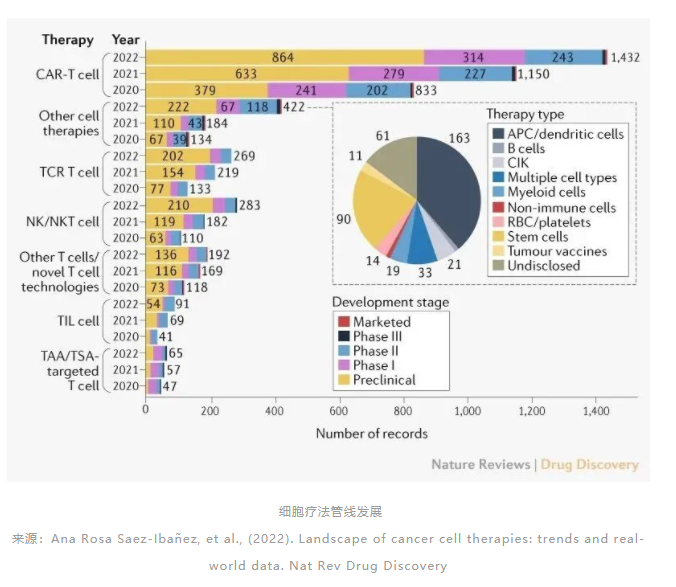 CAR-T细胞疗法仍然数目最多,不过比去年相比增长24%,低于2020—2021年38%的增幅。基于自然杀伤(NK)细胞的疗法增长幅度也放缓,在过去一年中增长了55%(与前一年的65%相比)。
CAR-T细胞疗法仍然数目最多,不过比去年相比增长24%,低于2020—2021年38%的增幅。基于自然杀伤(NK)细胞的疗法增长幅度也放缓,在过去一年中增长了55%(与前一年的65%相比)。
相比之下,使用非T细胞和NK细胞的其它细胞疗法(如树突状细胞、干细胞或髓系细胞等)今年增长了129%,与2020—2021年的37%相比,增长迅速。其中,基于抗原呈递细胞/树突状细胞,和干细胞的细胞疗法占50%以上。
靶向TAA的细胞疗法增长了220%,主要由于基于其它细胞类型的疗法数目从2021年的20种增长到2022年的99种,涨幅超过400%。如上所述,这些细胞类型主要包括抗原呈递细胞/树突状细胞,和干细胞。这些疗法可能并不通过靶向单一靶点来行使它们的抗癌功能。治疗实体瘤的细胞疗法不但需要迁移到实体瘤中,还需要克服具有免疫抑制功能的肿瘤微环境。这些基于其它细胞类型的细胞疗法可能代表着改造肿瘤微环境的一个研发方向。
全球已获批上市的30多款基因治疗药物
通用型免疫细胞疗法,红海竞争下的蓝海市场
CAR-T细胞治疗面临的挑战及解决思路
回顾美股细胞治疗biotech十年经历
国内5家细胞疗法上市公司市值/管线/R&D
TCR-T细胞治疗技术研究进展
《免疫细胞药学指导原则》新规试行,带你解读十大新增内容
Ana Rosa Saez-Ibañez, et al., (2022). Landscape of cancer cell therapies: trends and real-world data. Nat Rev Drug Discovery
细胞免疫疗法——让“谈癌色变”成为过去式


文章评论(0)