ADC技术报告:下一代ADC发展前景预测
作者:北北
抗体偶联药物(ADC)是近年来肿瘤治疗的热门赛道,通常由单克隆抗体(mAb)通过化学合成的连接子(linker)与细胞毒性药物(payload)共价连接。ADC结合了高度特异性靶向能力和高效杀伤作用的优点,实现了对癌细胞的精确高效清除。
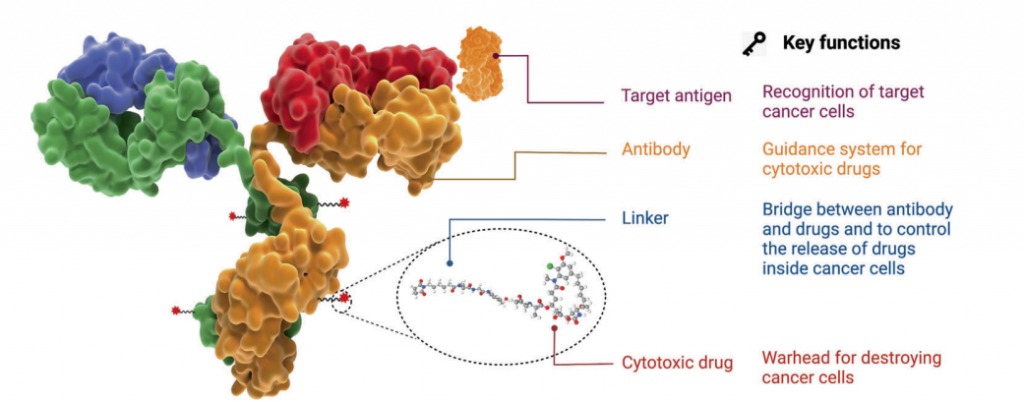
图1. ADC药物的结构和特性
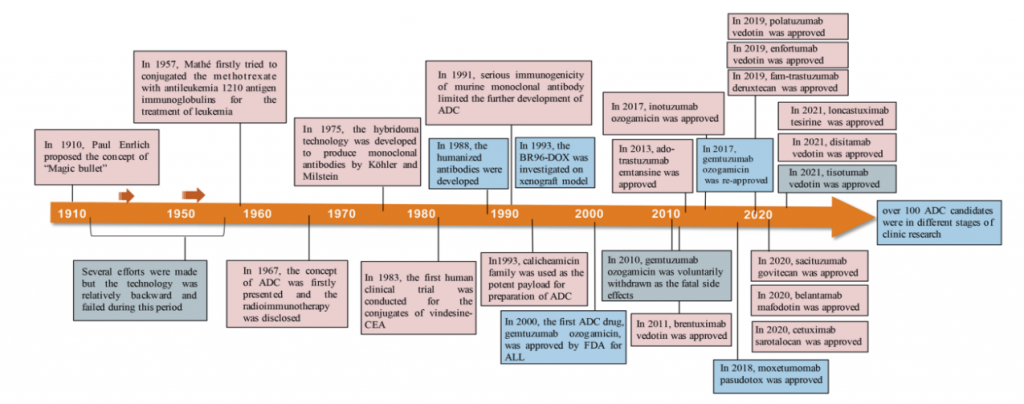
图2. ADC药物开发和批准过程中的重要事件
但创新肿瘤产品的研发之路并非是一路坦途,ADC赛道亦如此。以第一款全球上市的ADC产品Mylotarg® 和近日III期临床试验失利的Blenrep® 为例。
- 2022年11月7日,葛兰素史克公司的靶向BCMA的ADC产品Blenrep®(belantamab mafodotin)在一项针对一种血癌患者的三期临床试验(DREAMM-3)中,由于单药治疗与泊马度胺联合低剂量地塞米松对照组相比,没有达到无进展生存期(PFS)的主要研究终点,宣告失败。此前,Blenrep(belantamab mafodotin)已获得美国FDA的加速批准,作为一种单一疗法,用于治疗已经接受过至少四种治疗方法的复发或难治性多发性骨髓瘤(RRMM)成人患者。
- 2000年,FDA加速批准了辉瑞的靶向CD33的ADC产品Mylotarg®,作为一种单药疗法(高剂量)用于经历了首次复发、年龄≥60岁、不适合其他细胞毒性化疗的CD33阳性AML成人患者。这是Mylotarg®的首次上市,这也让它成为了全球第一个商业化的ADC产品。但上市后不久,因安全性问题,2010年辉瑞宣布:Mylotarg®撤出美国市场。
- 2017年9月1日,辉瑞通过更新临床证据,调整药品规格和给药方案,再次获得FDA批准:(1)用于新诊断的CD33阳性AML成人患者;(2)用于年龄≥2岁、CD33阳性、复发或难治性AML儿童和成人患者。
ADC的疗效和安全性,治疗窗口,靶点限制,实体瘤和血液肿瘤的异质性等,都成为ADC研发的掣肘因素。
本文期望通过回顾ADC的发展历程和作用机制,探讨ADC关键成分以及这些关键因素影响ADC活性的作用机制,并对下一代ADC产品发展前景进行预测。
- 首先,为了减少脱靶毒性(off-target toxicity),靶向抗原应在肿瘤细胞中表达或主要表达,但在正常组织中表达或很少。理想情况下,抗原是表面(或细胞外)抗原而不是细胞内抗原,以便被循环的ADC识别。例如,与正常细胞相比,某些类型的肿瘤中HER2受体的表达大约高100倍,这为ado-曲妥珠单抗emtansine(TDM-1,KADCYLA®)、fam-曲妥珠单抗deruxtecan(DS-8201a,Enhertu®)和disitamab vedotin(RC48,Aidixi ®)的开发奠定了坚实的基础;
- 其次,靶抗原应该是非分泌的,因为循环中分泌的抗原会导致不希望的ADC在肿瘤部位外结合,导致肿瘤靶向性降低和毒副反应增加;
- 第三,靶抗原能够理想地在与相应抗体结合时被内化,从而ADC抗原复合物有效进入癌细胞,随后是适当的细胞内运输途径和细胞毒性有效载荷的快速释放。
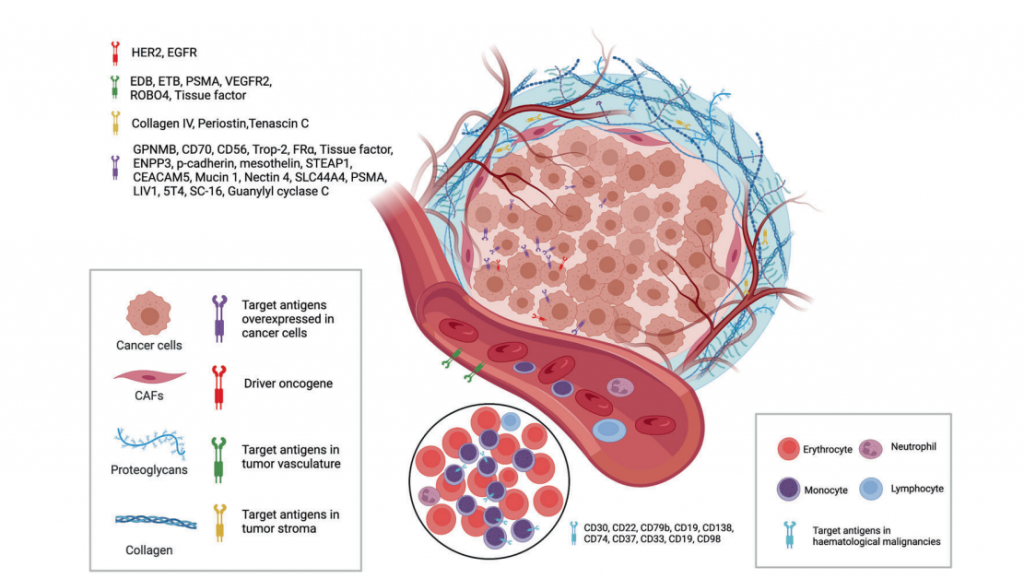
图3. ADC可用的来自肿瘤细胞和肿瘤微环境的靶点
目前,如上图所示,经批准的ADC药物的靶抗原通常是在癌细胞中过表达的特异性蛋白,包括实体瘤中的HER2、trop2、nectin4和EGFR,以及血液恶性肿瘤中的CD19、CD22、CD33、CD30、BCMA和CD79b。在肿瘤学和免疫学基础研究的推动下,ADC靶抗原的选择逐渐从传统的肿瘤细胞抗原扩展到肿瘤微环境中的靶点,例如基质和脉管系统。临床前和临床研究不断涌现出的新证据表明,新生血管系统、内皮下细胞外基质和肿瘤基质的成分可能是ADC药物开发的有价值的靶抗原。
- IgG1是ADC的常用抗体亚型,因为IgG1是血清中含量最丰富的,并且可以通过与Fc受体的高结合亲和力诱导强效应功能,如抗体依赖性细胞介导的细胞毒性(ADCC)、抗体依赖性吞噬作用(ADCP)和补体依赖性细胞毒性(CDC)。这些Fc介导的效应子功能在抗体药物的抗癌活性中起着至关重要的作用。
- 由于清除率快,IgG3很少用于ADC。与半衰期约为21天的其他三种亚型不同,IgG3在血清中的半衰期仅约为7天。
- IgG2在体内经常表现出形成二聚体和聚集的趋势,这导致ADC药物的浓度降低。
- IgG4可以诱导ADCP,然而,IgG4是一种具有Fab臂交换的异常动态抗体,导致效力降低和靶向效果无效。
关于抗体-抗原复合物的内化,效率主要取决于抗体与肿瘤细胞表面抗原之间的结合亲和力,其中较高的亲和力通常导致更快的内化。然而,具有高抗原亲和力的抗体可能反过来减少对实体瘤的渗透。实体瘤的治疗比血液肿瘤更复杂,因为实体瘤中存在“结合位点屏障(BSB)”,其中,抗体和抗原之间的极强结合导致ADC在血管外渗后被捕获在血管附近,但较少渗透到远离血管的肿瘤细胞。因此,应优化抗原和抗体之间的合理亲和力,以平衡靶细胞中的快速吸收和抗癌效力。
除了结合亲和力,影响肿瘤渗透的另一个因素是抗体的大小。IgG抗体的大分子量(约150kDa)往往限制其在肿瘤组织中的毛细血管和基质的渗透能力。因此,早期ADC主要针对血液恶性疾病。为了使ADC更好地应用于实体瘤治疗,研究人员试图通过去除FC片段来将抗体小型化。小型化抗体不仅保持了高亲和力和特异性,而且更容易通过血管渗透到实体瘤中,从而大大提高了对实体瘤的杀伤效果。然而,这种变化会导致体内半衰期的缩短。因此,在设计具有小型化抗体的ADC时,应综合考虑各种因素做出合理优化。
可裂解接头利用体循环和肿瘤细胞之间的环境差异,准确释放游离的细胞毒药物,可进一步分为化学裂解接头(腙键和二硫键)和酶裂解接头(葡糖苷酸键和肽键)。另一种对还原性谷胱甘肽 (GSH) 敏感的化学敏感的可切割接头。GSH 在细胞存活、细胞增殖和分化过程中对维持细胞内氧化还原平衡起着至关重要的作用。血液中 GSH 的浓度远低于癌细胞中的细胞内浓度。因此,这种类型的接头可以在血液系统中保持稳定,同时特异性地释放癌细胞中的活性有效载荷。
基于肽的接头对溶酶体蛋白酶敏感,并已用于许多 ADC。溶酶体蛋白酶,如组织蛋白酶 B,通常在癌细胞中过度表达,从而能够在肿瘤附近准确释放药物。另外由于血液中存在蛋白酶抑制剂,酶裂解的Linker在体循环中通常是稳定的,因此酶可裂解的linker降低了过早断裂带来的各种风险。在批准的 ADC 药物中,14 种药物中有 9 种使用基于肽的接头。
不可切割的接头(例如硫醚或马来酰亚胺基己酰基)对体内常见的化学和酶环境是惰性的,由于血浆稳定性的提高不可切割接头的最大优势在于其较低的脱靶毒性,但有效载荷的旁观者效应受到影响。
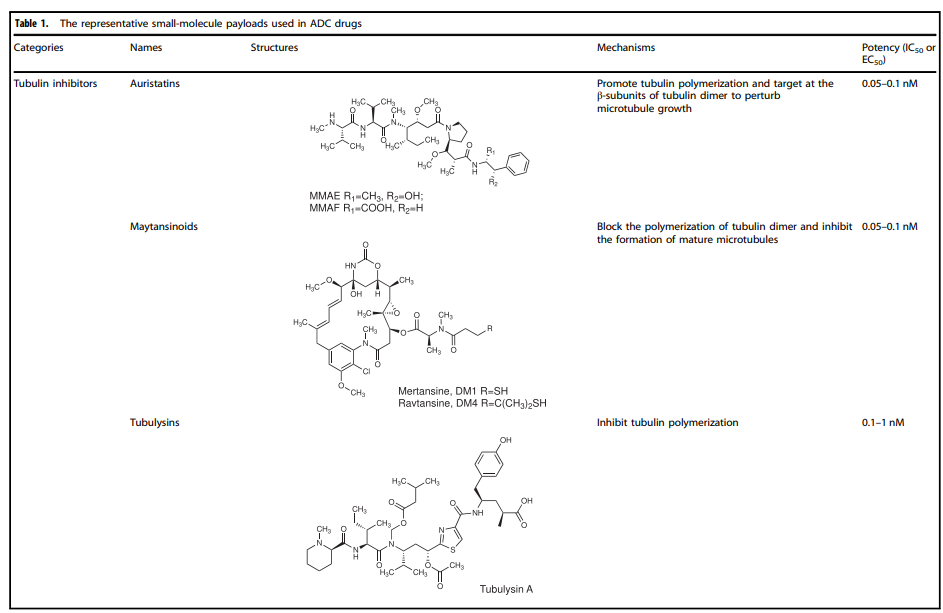
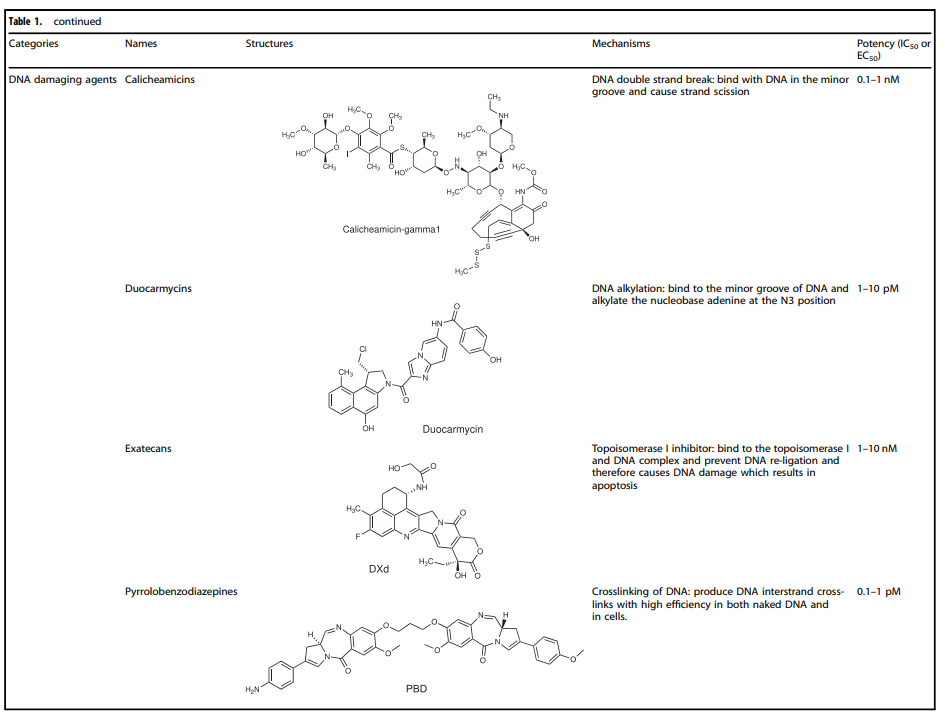
表1. ADC药物中使用的代表性小分子有效载荷
正是payload本身存在的各种抑制肿瘤细胞生长或直接杀死肿瘤细胞的功能,丰富了ADC药物的作用机制。
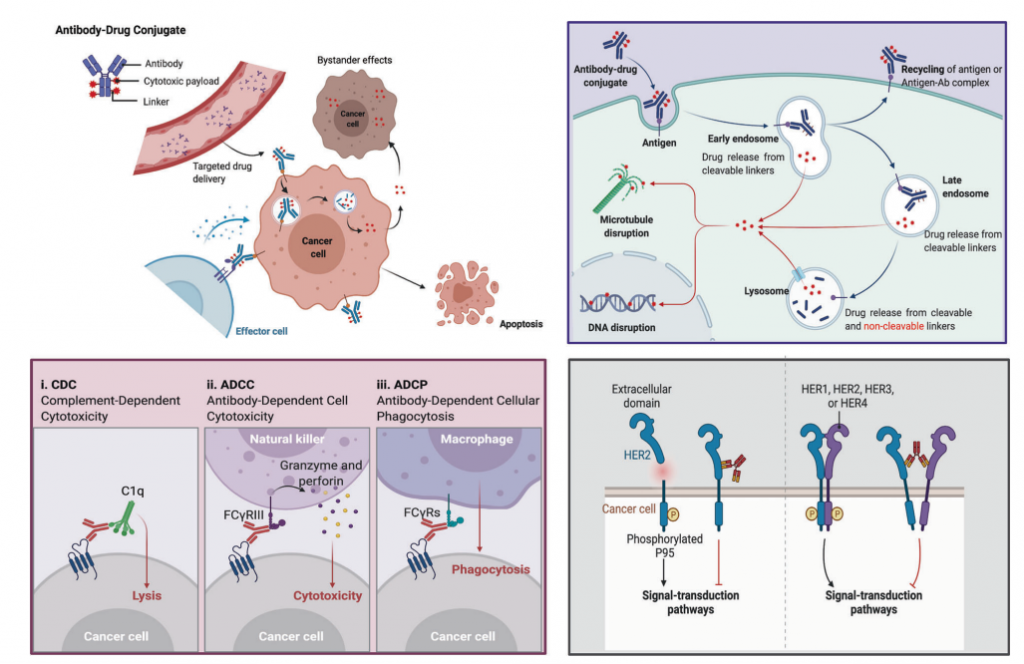
图4. ADC通过不同方法杀死癌细胞的机制概述
右上:ADC的主要核心作用机制;左下:ADC的抗体成分与免疫效应细胞结合,引发抗肿瘤免疫,包括CDC、ADCC和ADCP效应;右下:ADC的抗体组分保留其活性特征,因此可以干扰靶功能,抑制抑制肿瘤生长的下游信号传导。
即使有诸多的抗肿瘤作用机制,源自于本身ADC的肿瘤靶向清除作用,抗体接到的细胞毒效应,payload的多种抗肿瘤机制。但ADC成功的关键是抗体和payload及linker的共轭方法。
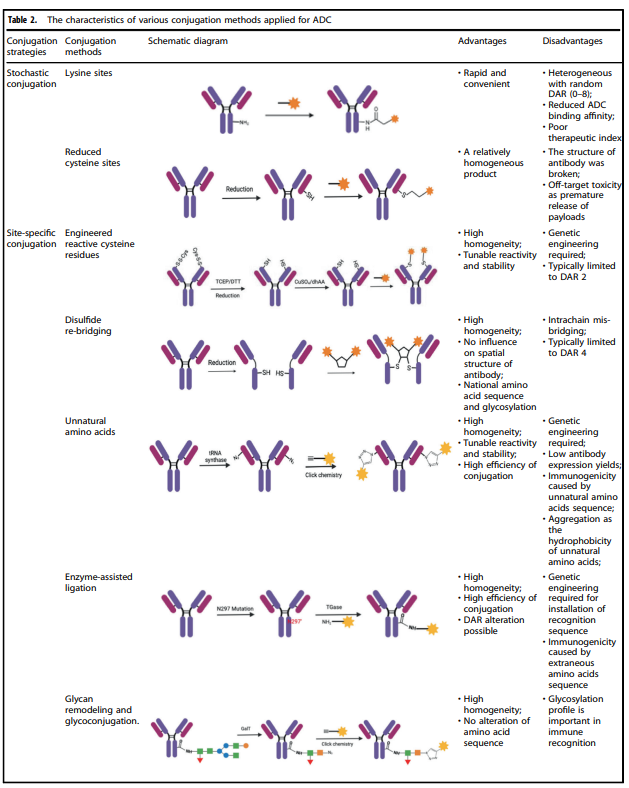
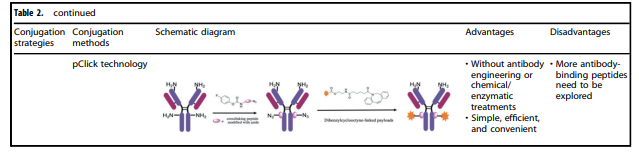
表2. 应用于ADC的各种共轭方法的特征
表2详细汇总了目前常用的ADC的各种共轭方法的特征。其中,化学偶联和酶偶联是目前使用最多的抗体和有效载荷组分的两种连接方法。
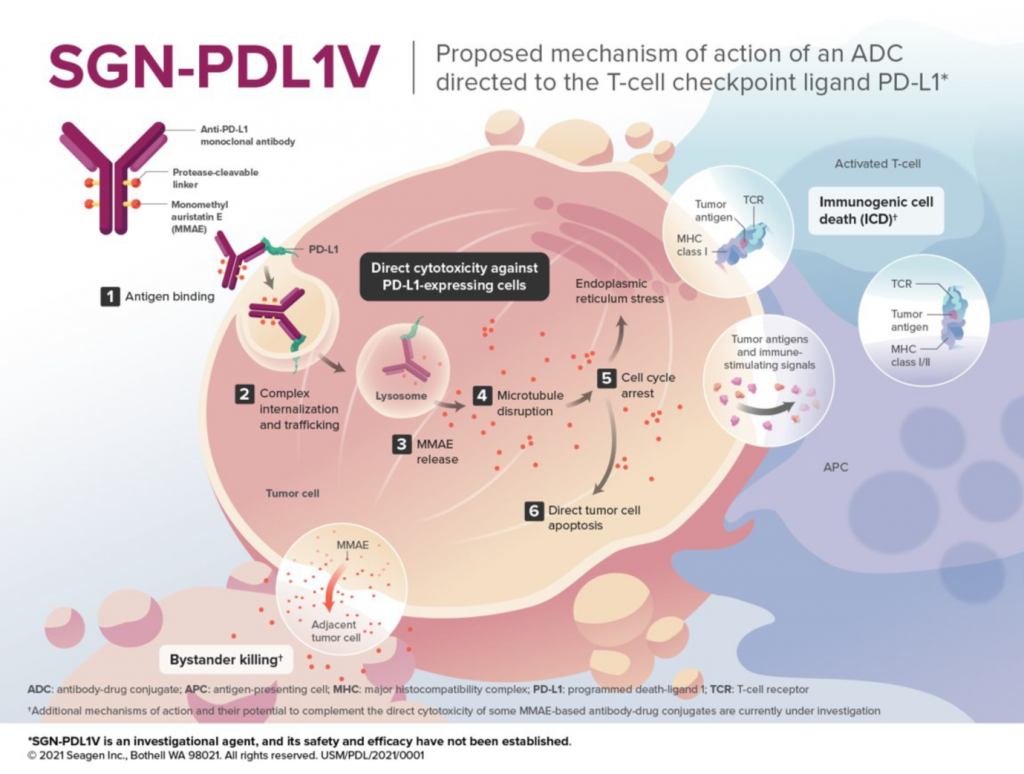
图5. SGN-PDL1V 作用机制(来源:2021SITC)
例如,Seagen管线中处于研发早期阶段的SGN-PDL1V,靶向PD-L1的新型ADC产品, Payload采用的是MMAE, MMAE(一甲基澳瑞他汀E)是ADC使用最广泛的有效载荷,约占总数的30%,主要通过抑制微管蛋白聚合而起到有效的有丝分裂抑制作用。
ADC在肿瘤组织中显示>100倍的药物浓度,大大扩大了细胞毒素的治疗窗口,能够有效减少全身化疗导致的毒副反应,从而有效实现ADC与其他肿瘤治疗手段的连用探索。
其次,SGN-PDL1V的连接子为蛋白酶可切割型。抗体为全人源的抗PD-L1单克隆抗体(Seagen PD-L1单抗)。Seagen PD-L1单克隆抗体利用人类IgG1-Fc骨架,经过工程化改造,消除了Fc段的效应器功能,包括补体依赖性细胞毒性(CDC)、抗体依赖性细胞毒性(ADCC)和抗体依赖性细胞吞噬作用(ADCP)。
另外,鉴于单靶点抗体往往具有高耐药率,双靶点双抗作为ADC的抗体也有企业在探索中。
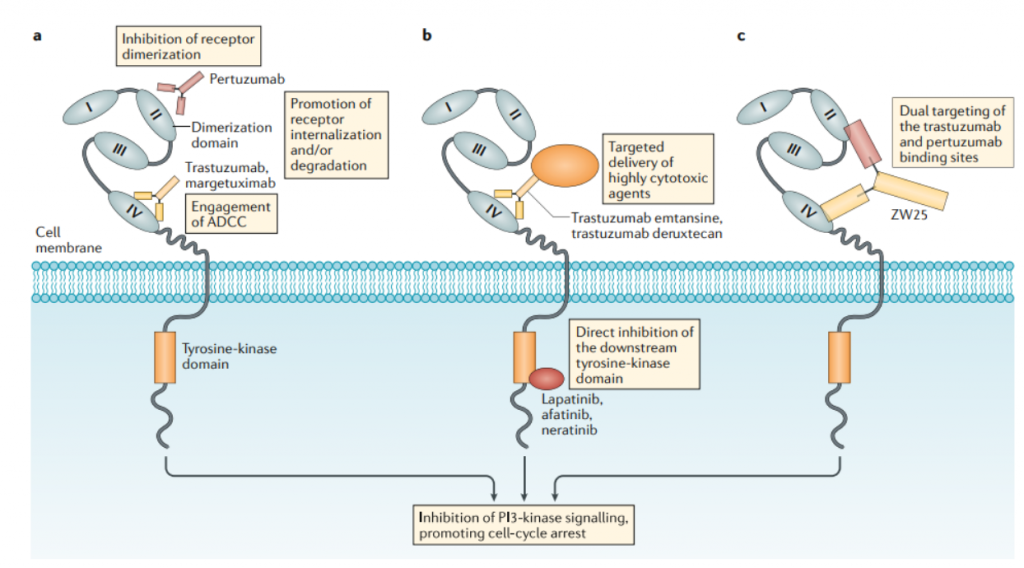
图6. 靶向HER2的药物的作用机制
该领域目前研究尚处于早期探索阶段,进展最快的是ZW-49,是Zymeworks利用其专有的Azymetric™ Bispecifics和ZymeLink™ ADCs平台共同开发得到的双特异性抗体ADC药物。能够同时特异性结合HER2受体的两个非重叠表位,即帕妥珠单抗结合位点和曲妥珠单抗结合位点。以期在临床应用中,对于曲妥珠单抗、帕妥珠单抗,甚至TDM-1等新型ADC药物耐药的患者,起到良好治疗效果。
期待未来有更多新型ADC不断商业化上市,惠及更广泛的实体瘤和血液肿瘤领域的患者。
(了解更多详情,关注VXGZH:贝壳社)
参考资料:
1. Signal Transduction and Targeted Therapy (2022) 7:93
2. Bioorg Chem. 2021 Nov;116:105366.
3. Oh DY, et al. Nat Rev Clin Oncol. 2019;10.1038/s41571-019-0268-3.
4. Mark D. Pegram, et al. Mol Cancer Ther; 20(8) August 2021.


文章评论(0)