刚刚,两款新药获得CDE拟突破性疗法认定,来自拜耳、冠科美博
刚刚,又有两款新药被CDE纳入拟突破性疗法认定。
12月24日,国家药品监督管理局药品审评中心(CDE)网站最新公示,拜耳(Bayer)的PI3K抑制剂copanlisib注射用冻干制剂、冠科美博的E-选择素拮抗剂uproleselan注射液拟纳入突破性治疗品种。根据CDE官网显示,截至目前,已经有15种新药被纳入突破性疗法,另外10种新药处于拟纳入突破性治疗品种。
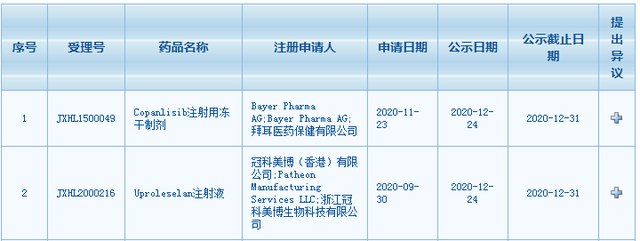
截图自CDE官网
以下是两款药物的主要信息:
01 药物名称:copanlisib注射用冻干制剂
公司:拜耳
拟用于:治疗既往接受过至少两线治疗的复发性边缘区淋巴瘤成人患者。
Copanlisib是一种通过静脉注射的泛Ⅰ类磷脂酰肌醇-3-激酶(PI3K)抑制剂,对于在恶性B细胞中表达的4种PI3K亚型(包括PI3K-α和PI3K-δ亚型)均具有抑制活性。其中PI3K通路参与细胞的生长、存活和代谢,其失调在淋巴瘤的发生发展中起着重要作用。
基于Copanlisib单药治疗104例至少两次系统治疗后复发或难治性成人滤泡性B细胞NHL患者的开放标签、单臂II期CHRONOS-1研究(NCT01660451)的结果,其中总缓解率(ORR)可达59%,包括14%的完全缓解(CRs)。Copanlisib于2017年获FDA加速审批,用于治疗至少接受过两次系统治疗的复发性滤泡性淋巴瘤(FL)的成年患者。
Copanlisib是目前获批的唯一一种间歇性静脉注射的PI3K抑制剂,可在每28天的治疗周期的第1天、第8天和第15天给药。
2019年5月,基于关键性II期CHRONOS-1研究中复发性边缘区淋巴瘤(MZL)亚组的数据,其中整体全惰性非霍奇金淋巴瘤(iNHL)人群的总反应率(ORR)为59.2%,而MZL患者为69.6%。Copanlisib获得FDA突破性治疗认定用于治疗既往接受过至少2种疗法治疗的复发性边缘区淋巴瘤(MZL)成年患者。
02 药物名称:uproleselan注射液
公司:冠科美博
拟用于:成人复发或难治性急性髓系白血病(AML)。
Uproleselan (GMI-1271, APL-106) 是由GlycoMimetics发现和开发的创新药。Uproleselan作为一种小分子E-选择素拮抗剂,它本身没有细胞毒性,因此无法直接杀死AML细胞,但却能阻断E-选择素(骨髓细胞上的一种粘附分子)与血液癌细胞结合,从而阻断骨髓微环境中白血病细胞的耐药机制。与此同时还能降低化疗引起的炎症反应。
Uproleselan用于治疗复发或难治性成人AML,在美国处于III期临床试验阶段,且已获得美国FDA突破性疗法资格。在一项针对新诊断的老年AML患者和复发或难治性AML患者的I/II期临床试验中,与第三方临床试验中的历史数据相比,标准化疗联合Uproleselan治疗的患者获得了比预期更好的缓解率(RR)和总生存期(OS),以及低于预期的诱导相关死亡率。患者对治疗的耐受性良好,不良反应也少于预期。
Uproleselan是冠科美博于2020年1月从美国GlycoMimetics引进,冠科美博拥有中国市场(中国大陆、香港、澳门和台湾)的临床开发、生产和商业化销售权利。2020年9月,Uproleselan注射液获得国家药品监督管理局(NMPA)核准签发的《药物临床试验批准通知书》,同意开展针对中国成人复发或难治性急性髓系白血病的I期和III期桥接临床研究。
急性髓系白血病(AML)是一种进展迅速的血液和骨髓癌症。从目前的治疗来看,适合接受骨髓移植的患者的比例很低,而且大多数患者对化疗无响应并进展成复发/难治性AML。复发/难治性AML因其自身特性难以达到完全缓解,并发症多,生存期短,治疗极为困难。
期待Uproleselan能够成功上市,让致命血癌AML变得有药可医。


文章评论(0)