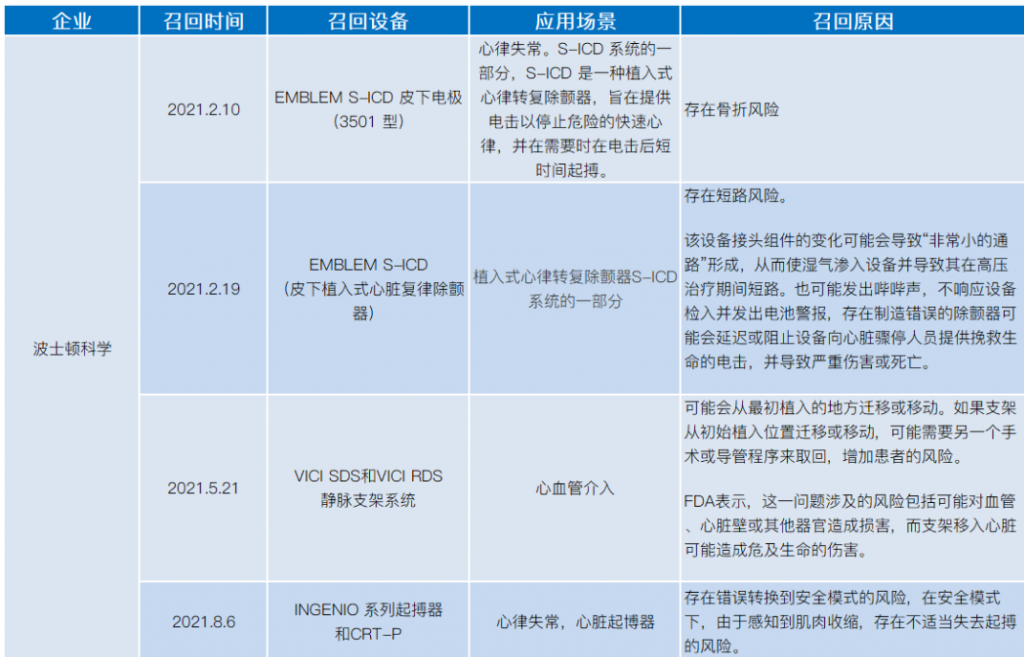
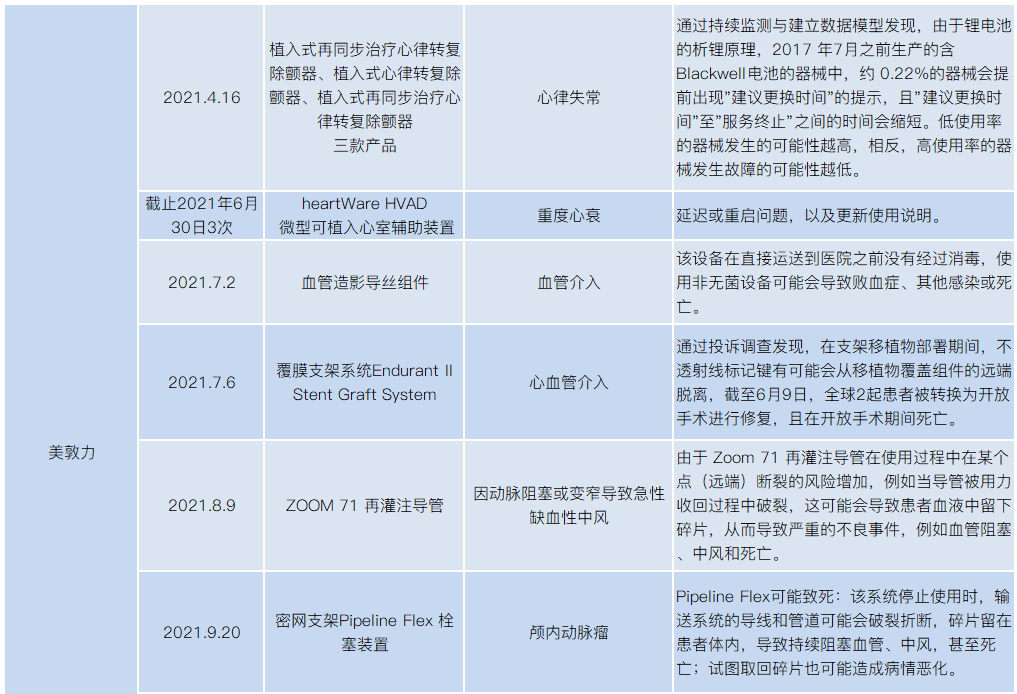
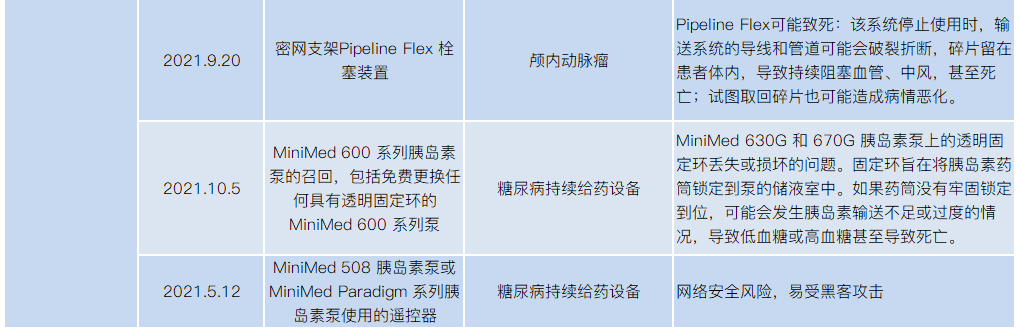
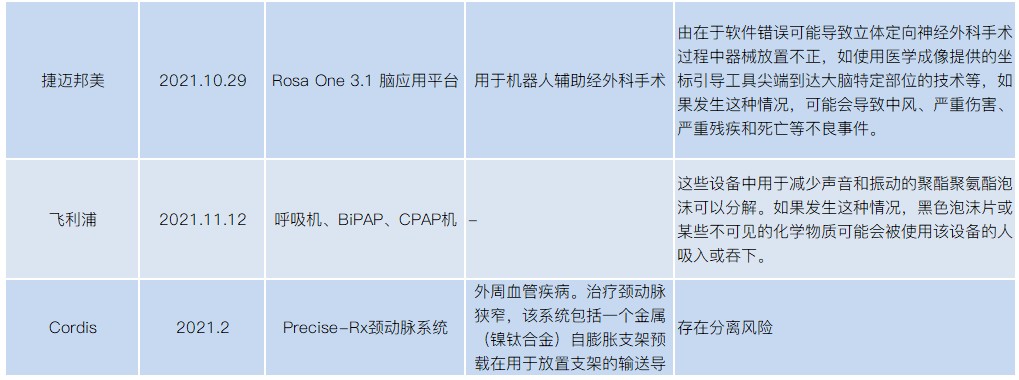
2021年医械设备召回,涉及飞利浦、美敦力、波科
美国电子产品研究所(ecri)工程总监克里斯•拉万奇(chris lavanchy)认为,仅通过召回数量来确定产品的整体问题很具挑战性,理解召回或召回的原因至关重要。“(召回)可能是他们对软件进行了更改,可能是像电缆和机械之类的东西出了问题。因此,了解整个历史真的很重要,” lavanchy 说。
且召回主要由制造商自愿发起。某医疗器械公司质量负责人也曾表示,医疗器械召回制度已是国际上非常成熟有效的,用于管理存在隐患的医械设备的模式,“医械产品有它的特殊性,生产工艺很复杂,不可避免会出现瑕疵产品。发现问题后主动召回是负责任的表现,降低医疗器械在使用中的风险。”
但往往一级召回意味着可能会导致死亡的发生,也有因此唱衰的声音。
有行业观点认为,一再的产品召回可能导致企业失去市场,也会危及患者的生命。例如美敦力宣布已停止分销和销售其 HeartWare 心室辅助装置 (HVAD) 系统时,雅培发表声明称,确已准备好满足对植入式心脏泵的新需求增长。“确保持续使用这些设备对患者来说至关重要,”雅培电生理和心力衰竭业务高级副总裁 Mike Pederson说,“我们正在努力确保医生在采用 HeartMate 3 以改善晚期心力衰竭患者的预后时获得他们所需的支持和培训。”
而在国内,集采之下甚至有“医疗应该成为福利性行业”的呼声出现,这显然是不现实的。
作为高研发投入、高时间成本的赛道,医疗行业尚处于发展初期。医疗AI等新兴赛道的产品也是在今年才完成首次上市,与成熟医械设备一样面临着严格的全生命周期的监管。
尚未完全蓬勃的产业仍旧需要依靠资本和市场的打磨,而这个过程中如何实现临床、市场和医保的三方利益协同,也仍旧需要一段时间的磋商。未来,贝壳社将持续关注。


文章评论(0)