PD药物将进入细胞疗法时代
据世卫组织数据,目前全球 65岁以上人群PD患病率约为1.7%,80岁以上人群患病率约为3%。且正趋于年轻化,青少年型PD患者占总人数的10%。据世界帕金森协会统计,目前全球共有570万PD患者,我国约有300万。随着老龄化逐渐加剧,预计2030年我国PD患者将达到500万人,将占到全球患者数量的一半。另据新思界产业分析数据,2021年我国公立医院抗PD药物市场被勃林格殷格翰等8家外资药企瓜分,份额共近90%。余下的约10%留给国产药物。可以见得,对于本土企业,PD药物的研发刻不容缓。不过可喜的是,本土企业亦实现仿制药上市,且接连获得新药研发突破。
另一方面,目前临床上以左旋多巴、DBS为代表的化药、物理治疗方案,及其他辅助治疗方案,均无法解决患者脑部功能神经元的缺失问题,且副作用大。因此国内外一些药企从细胞疗法入手,试图解决这一难题,效果令人惊喜,PD的治愈或不再是神话。
海内外均有好消息
目前,世界范围内还没有一种疗法能够阻止、替代或预防多巴胺神经元的丧失或减缓PD的进展。前文所述Aspen Neuroscience将启动ANPD001临床试验的消息无疑振奋人心。ANPD001是一种自体细胞疗法,可作为PD的自体神经元替代物。该疗法从PD入手,使用从患者皮肤细胞中提取的诱导多能干细胞(iPSC)制造多巴胺神经元前体细胞(DANPCs)。在植入这些细胞之前,使用强大的质量控制检测,包括基于人工智能的基因组学检测来评估其潜在活力。下一步,Aspen将启动针对中重度PD患者的首例1/2a期临床试验。
另一则好消息来自中国。今年8月2日,睿健医药PD新药NouvNeu001的IND申请获得国家药监局正式批准。这也是PD治疗领域较早进入临床阶段的基于化学诱导的通用型细胞治疗产品。NouvNeu001利用诱导多能干细胞培养获得健康的多巴胺神经前体细胞,移植入体内后可高效转化为成熟多巴胺能神经元,弥补多巴胺能神经元的不足。同时分泌多巴胺递质,与体内原有神经元形成神经连接,产生综合性的治疗功能。从已完成的试验结果来看,使用NouvNeu001治疗的各类疾病模型动物在给药四周后,不仅行为学功能得到了极大恢复,而且其多项生理生化指标得到显著提升。
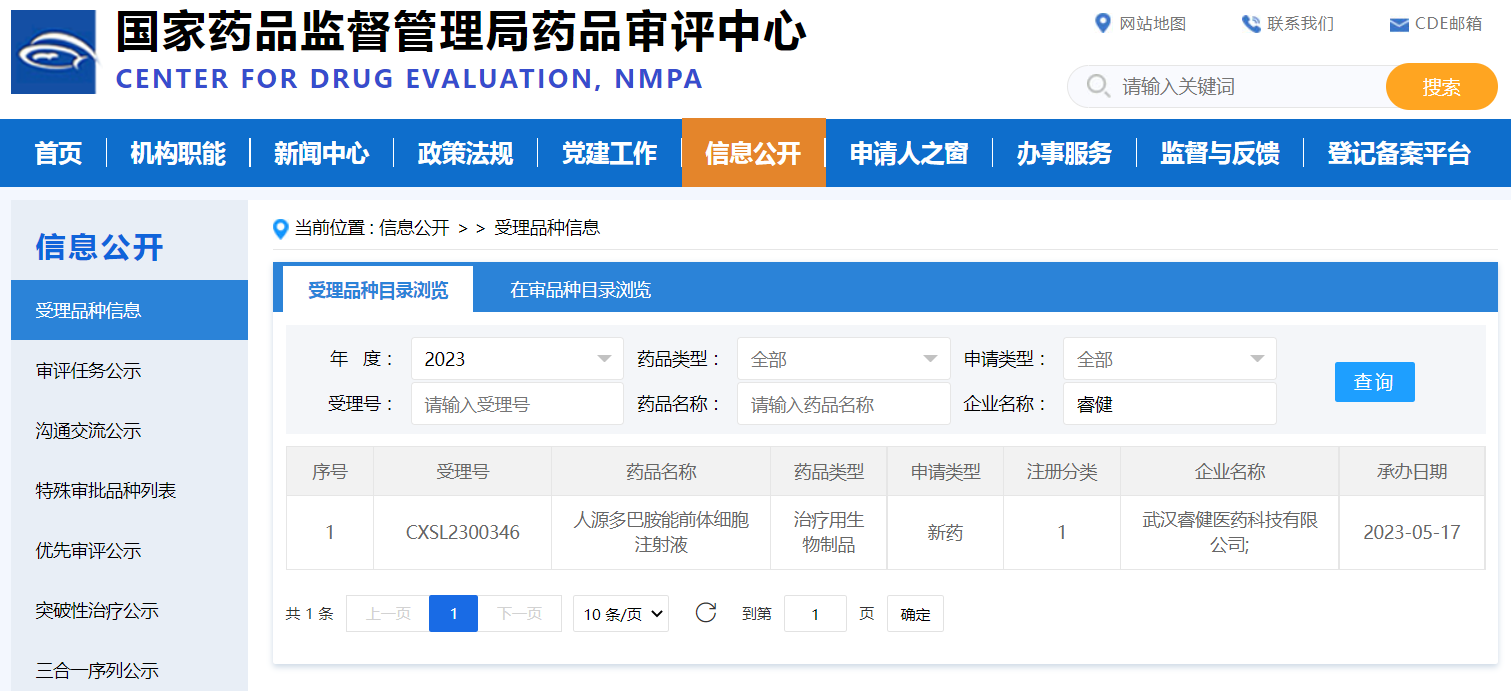
来源:国家药品监督管理局药品审评中心官网
相比之下,拜耳旗下BlueRock公司的胚胎干细胞(ESCs)衍生药物MSK-DA01则最短需要在给药十二周后才能起效。MSK-DA01用于治疗晚期PD,2021年IND获FDA批准,2023年6月28日宣布完成了临床I期安全性试验。
沙芬酰胺、奥匹卡朋将上市

来源:国家药品监督管理局药品审评中心官网
与LY03003七天一次的用药频率相比,Bial制药的奥匹卡朋(opicapone,商品名为Ongentys)的用药评率则为一天一次。
奥匹卡朋为新一代外周儿茶酚O-甲基转移酶(COMT)抑制剂,由葡萄牙Bial-Portela公司开发。分别于2016年、2020年在德国、美国获批。奥匹卡朋是第一种也是唯一一种获批的每日一次COMT抑制剂。可有效减少PD患者的“关闭”时间,增加“开启”时间,且不会出现运动障碍。复星医药子公司江苏万邦生化医药集团有限责任公司在2018年1月9日与Bial达成协议,引进Ongentys的中国大陆开发权益(不包括港澳台),目前处于III期临床。
而另一款PD药物沙芬酰胺,有望在奥匹卡朋之前在中国上市。
沙芬酰胺是一种针对MAO-B的第3代选择性抑制剂,于2017年被美国FDA批准用于治疗PD,具有选择性高、安全性好等优点,被誉为美国治疗PD的重要里程碑。与第1、2代MAO-B抑制剂相比,沙芬酰胺对MAO-B的选择性更高,而且对单胺氧化酶的抑制作用是可逆的,MAO-B的生理活性在停药8h后可以完全恢复。沙芬酰胺发挥治疗PD作用的机制除了通过多巴胺能系统以外,还通过抑制谷氨酸的释放、抑制钠离子通道的开放、调节钙离子通道等机制。多种作用途径与多个作用靶点共同调节,更好地发挥抗PD作用。2022年4月,沙芬酰胺片在中国递交上市申请并获受理,预计今年可获上市。
除此,本土针对MAO-B靶点开展PD适应症的企业还有京新药业、东阳光药。
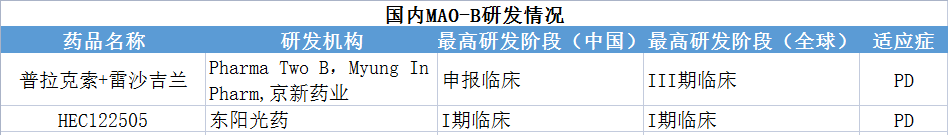
数据来源:凯莱英药闻,贝壳社制图
本土药企加速仿制欲替代
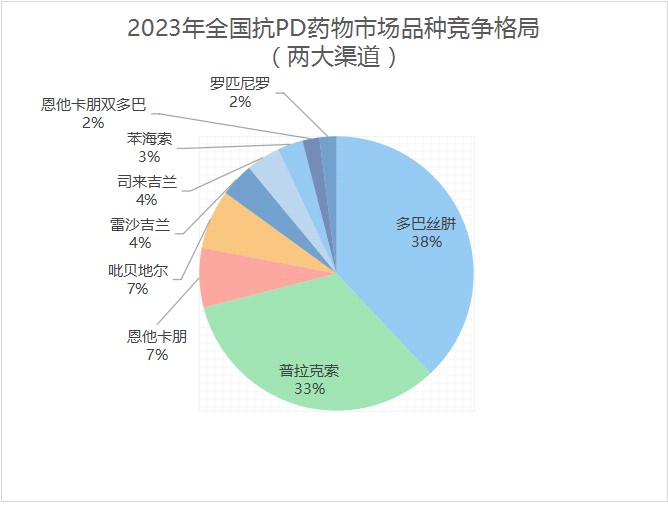
数据来源:中康CMH,贝壳社制图
多巴丝肼是PD药物治疗中最有效的对症治疗药物,被称为“金标准”用药。从国内企业来看,山东新华制药、上海福达制药等均有布局,但市场被罗氏占据绝对高位。普拉克索方面,京新药业(索普乐)、石药集团(恩悉)、齐鲁制药(齐舒宁)等企业为首发力仿制药研发,助力仿制药市场份额快速提升,打破了原研药垄断市场的局面,加快了仿制药替换原研药的速度。
另外值得一提的是,今年5月8日,创新生物制药公司杭州畅溪制药有限公司与制药公司Acorda Therapeutics就INBRIJA®(左旋多巴吸入粉雾剂)在大中华地区(中国大陆及港澳台地区)的临床应用达成一项合作。据悉,INBRIJA®是第一个获得FDA批准的吸入性左旋多巴,已在美国和欧盟获批上市,用于正在接受左旋多巴-多巴脱羧酶抑制剂治疗的成年PD患者。该药便于患者自己操作,适用于“关”期(OFF episodes)的按需治疗。
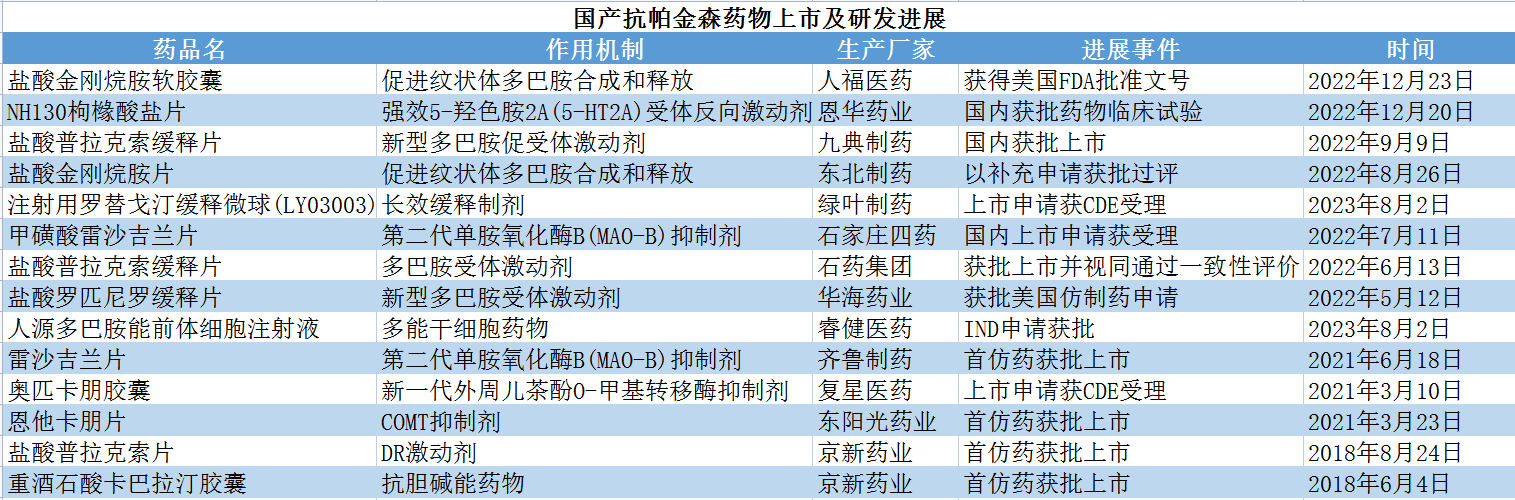
数据来源:各药企公告、CDE,贝壳社制图
当前,药物治疗依然是中国PD治疗的首选,且市场长期以来受外资垄断。想要实现突破,需要加快提升仿制药的技术及疗效。此外,随着本土企业研究的不断深入,新靶点、新疗法不断出现,细胞疗法成效初显,给市场及患者很大惊喜。相信在未来,PD治愈将会实现。
参考资料:
1.《我国已有17种抗帕金森病药物获批上市,成长空间巨大》,人民日报健康客户端,2023-04-11.
2.《用化学诱导iPSC药物“逆转”不可逆的“绝症”,「睿健医药」帕金森新药IND获批 》,36氪,2023-08-03.
3.《速递|首个!帕金森病的自体细胞疗法人体试验获批启动,可替代受损的神经元发挥作用》,药明康德,2023-08-10.
4.《绿叶制药(02186):治疗帕金森病药LY03003上市申请获国家药监局受理并获纳入优先审评审批程序》,金融界,2023-08-01.


文章评论(0)