百亿美元市场背景下,PD-L1靶向ADC的想象空间有多大?
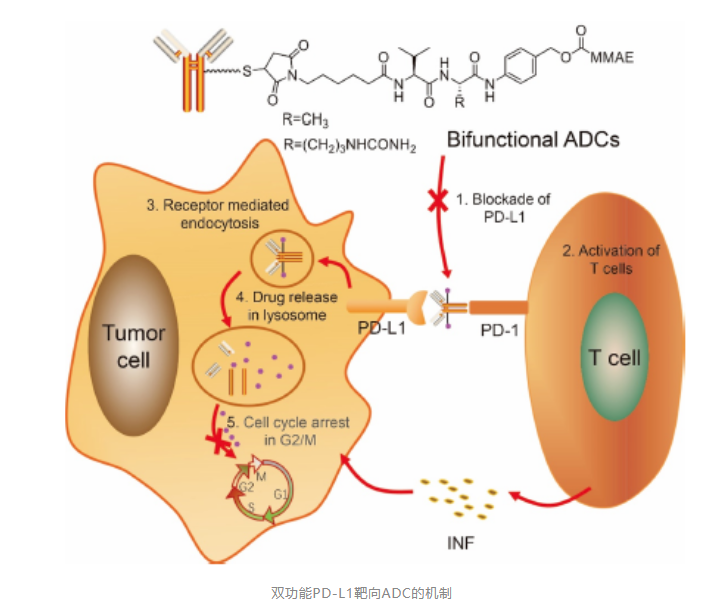
抗体偶联药物(ADC),可有效改善化疗药物的治疗窗口。因此,设计PD-L1靶向ADC药物,也是极具前景的研发方向。
为了提升肿瘤患者的响应率及治疗效果,抗PD-1单抗已经开始与化疗、靶向治疗和放疗进行联用探索。特别是化疗。由于化疗可以导致免疫原性细胞死亡,从而使更多的肿瘤抗原得以释放,有效促进免疫反应的激活。另外,还可以减少免疫抑制细胞的数量和活性。因此,化疗是免疫联合的主要选择方案。然而,化疗引起的全身副作用仍然是一个棘手问题。
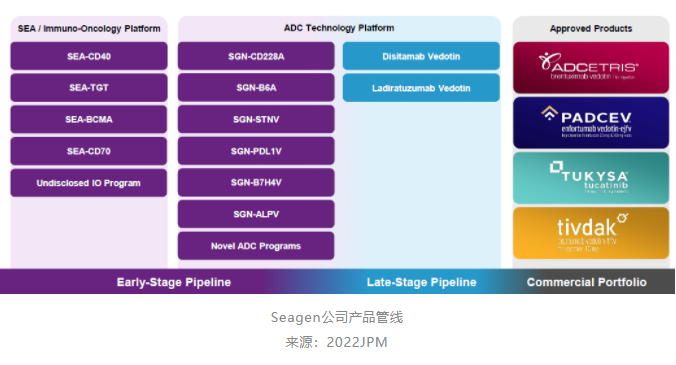
Seagen公司已经推动多款ADC产品实现了商业化的进程。鉴于Seagen的超强研发实力和产品管线前景,制药巨头默克发起对Seagen的收购,外界预估这笔交易规模有可能超过400亿美元。一时间,再次引爆外界对Seagen的研发管线的兴趣。
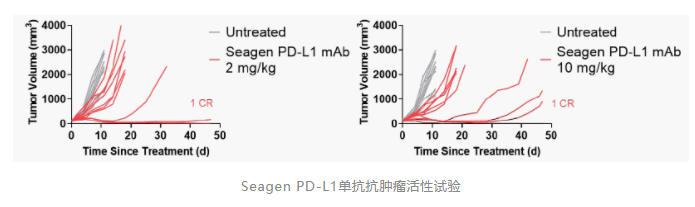
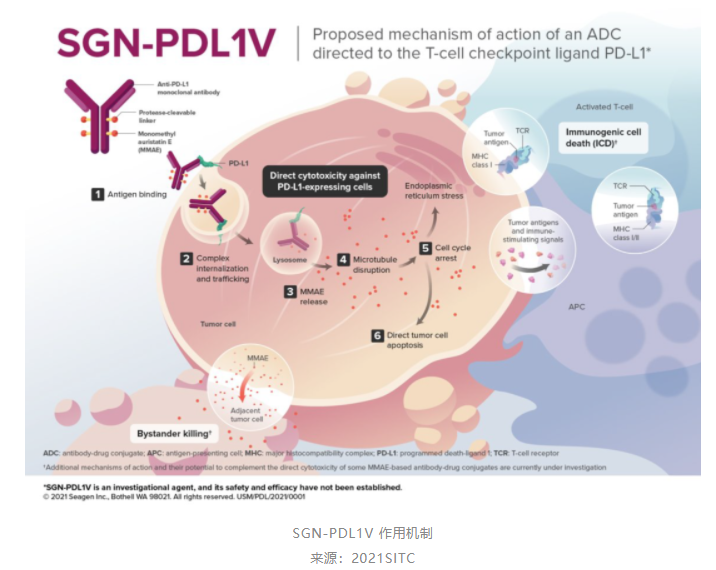
ADC在肿瘤组织中显示>100倍的药物浓度,极大扩大了细胞毒素的治疗窗口,能够有效减少全身化疗导致的毒副反应,从而有效实现ADC与其他肿瘤治疗手段的连用探索。其次,SGN-PDL1V的连接子为蛋白酶可切割型。抗体为全人源的抗PD-L1单克隆抗体(Seagen PD-L1单抗)。Seagen PD-L1单克隆抗体利用人类IgG1-Fc骨架,经过工程化改造,消除了Fc段的效应器功能,包括补体依赖性细胞毒性(CDC)、抗体依赖性细胞毒性(ADCC)和抗体依赖性细胞吞噬作用(ADCP)。
2021年癌症免疫治疗学会(SITC)年会期间,公布了SGN-PDL1V的临床前研究数据,特点如下:
SGN-PDL1V表现出高细胞内吞率和强细胞毒杀活性
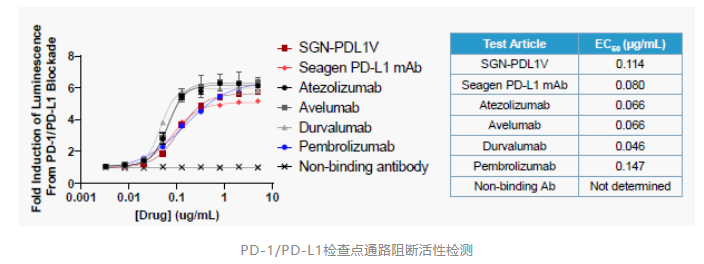
Seagen PD-L1单抗体内抗肿瘤活性提示PD-1/PD-L1检查点阻断活性:表达人PD-L1的免疫活性MC38模型能够实现PD-1/PD-L1检查点阻断活性的评判。(操作流程:将表达人PD-L1的MC38细胞皮下植入表达人细胞外结构域嵌合PD-1和PD-L1的雌性C57BL/6小鼠体内。当肿瘤体积达到100-150 mm3时,每3天静脉注射供试品,共3次。每个治疗组包括10只小鼠。)
Linker的选择
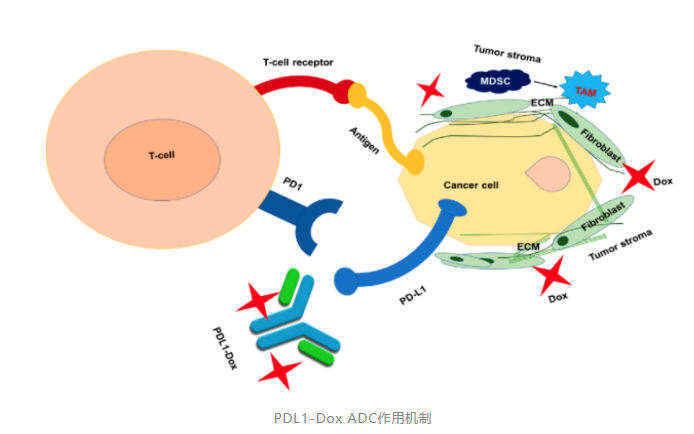
通过基础前研究发现,相较于阿维鲁单抗,阿替利珠单抗具有更高的内吞效率,是理想的PD-L1-ADC产品的抗体选择。
鉴于ADC和ICIs近年来在肿瘤治疗领域取得的突破性进展,已经有不少企业开始尝试ADC联合PD-1/L1抑制剂的联用探索,并取得了令人鼓舞的疗效数据。同时,正如本文介绍的Seagen公司的SGN-PDL1V,设计为PDL1-ADC,相较于ADC与ICIs的联用方案,会否能展示出更好的抗肿瘤活性和可耐受的安全性呢?这是另一个值得深究的话题。
参考文献:
[1] Signal Transduct Target Ther. 2022 Mar 22;7(1):93.
[2] CA CANCER J CLIN 2022;72:165–182.
[3] Bioorg Chem. 2021 Nov;116:105366.
[4] Oncotarget, 2017, Vol. 8, (No. 5), pp: 8807-8817.
[5] Cancers 2019, 11, 232; doi:10.3390/cancers11020232.


文章评论(0)