行研 | mRNA疫苗研究报告
2019年底2020年初,发源于湖北的新型冠状病毒以无人预料到的迅猛速度席卷整个中国,随着疫情的扩散,人们对疫苗的关注空前高涨。但传统疫苗的研发周期过长,以数年乃至十数年为周期,远水解不了近渴,对突发性传染病的抑制成效不显著。我们以17年前发生的非典作为比对,非典是于2002年底在中国开始爆发性传播,最终在2003年夏季逐渐被控制。但是相关疫苗的研发一直到2004年才启动人体试验,2006年才正式完成非典疫苗的研发,不过这个时候该病毒已经销声匿迹。
因此,越来越多的目光投向了近年来火热的mRNA疫苗,根据媒体报道,2020年1月28日,同济大学附属东方医院与斯微(上海)生物联手的新型冠状病毒mRNA疫苗研发正式立项。通过新兴的mRNA疫苗技术,将快速合成针对本次新型冠状病毒关键靶点的多种不同抗原序列的mRNA,并通过纳米脂质(LPP)载药技术制备成制剂,通过体内、动物实验,筛选和验证有效抗原,在此基础上将能在40天内完成大规模预防性2019-nCoV的疫苗样品生产、制备。
相比于传统医疗领域,RNA疗法可谓是另辟蹊径。相对于常规药物的研发与检测,mRNA的合成不仅简单快速,且价格低廉。同时这种人为设计的核酸材料并不会诱发人体的免疫反应,更重要的是,与稳定的DNA 不同,行使过功能的 mRNA随后便会降解,不会对人体产生其他的毒害或副作用。
本文聚焦于mRNA疗法与疫苗,试图挖掘在这一新兴领域的投资机会。
1、起源与发展
早在1990年,宾夕法尼亚大学的Katalin Karikó教授就提出,在基因疗法领域,mRNA疗法也许可以成为DNA疗法的替代。两者的长处一目了然,DNA疗法的作用即便不是永久,也是长效的,而mRNA能提供短期内的修正。对于由于基因突变导致的遗传病来说,DNA疗法也许更为适合。而在其他疾病领域,mRNA有一展拳脚的空间。
但在当时,mRNA疗法并没有取得医疗界太多的兴趣,其原因在于,其一,mRNA不是一种容易操作的分子,它不如DNA和蛋白质稳定,很容易被降解;但更重要的是,即便mRNA能被稳定提取并注射到动物体内,它也会引起一系列免疫反应,就像是身体在对抗病毒入侵一般,因此,它在安全性上有巨大隐患。
2005年,Katalin Karikó教授与同事Drew Weissman教授一道做出了一个突破性的发现——mRNA之所以能引起免疫反应,其关键在于一种叫做尿嘧啶的核苷酸。如果将其核苷部分进行简单的修饰,产生“假尿嘧啶”,就能逃脱免疫系统的监控。
解决了最重要的安全性问题后,mRNA疗法走上了快速发展的道路。2010年,利用类似的策略,哈佛大学的Derrick Rossi教授利用经过修饰的mRNA把成人细胞变成了胚胎样干细胞。单从技术本身而言,人们已经迈过了第一道难关。
在这之后,2012年,Afeyan博士与多位mRNA领域的资深科学家一道创立了Moderna,这也是目前在mRNA疫苗领域临床进展最快的公司。2013年Moderna在《Nature Biotechnology》上发表了一项研究,在小鼠心脏部位直接注射编码VEGF的mRNA,能够修复心脏病留下的组织损伤,解决了直接注射VEGF蛋白无法在心脏附近伤口停留从而无法修复组织损伤的问题。
此后,除Moderna之外,BioNTech、CureVac AG等公司也陆续开始研发mRNA相关产品管线。
2、作用原理
在自然界的生命体中,mRNA负责将遗传密码翻译成具有功能的蛋白,控制着每一个细胞的生命进程。mRNA将遗传信息传递给细胞,因此通过编码mRNA使其携带正确的信息,就可以让细胞产生的我们所需的抗病蛋白或是抗体。
mRNA药物与其他生物治疗药物相比存在较多优势:
1)mRNA易在体外生产和纯化,除去蛋白药物及病毒载体制备的复杂过程,同时可避免宿主蛋白及病毒源性污染;
2)IVT mRNA的生产工艺通用性强,可以快速应用于生产不同的目的蛋白,节省药物研发时间,提高效率;
3)mRNA仅需进入细胞质即可翻译成蛋白质,无需进入细胞核,因此不存在基因的插入和整合,提高药物的安全性;
4)通过调节序列修饰和递送载体可以改变其半衰期;
5)临床试验发现,虽然mRNA的蛋白质表达是短暂性的,但其对于肿瘤的免疫治疗应用有效,且有利于药代动力学和剂量的控制。
在mRNA众多开发方向中,疫苗成为mRNA领域一个比较好的切入点,这是从RNAi开发历程中吸取的经验。如果mRNA药物用静脉递送的话,会在肝脏蓄积,想要发挥作用就需要更大剂量,所以这类药的窗口期都很短。这方面导致的安全性问题是过去一些siRNA药物失败的重要原因之一。而疫苗是通过皮下给药,相对安全,且疫苗主要发挥“点火”作用,在于激发免疫系统,所以不需要做出严格的效应剂量比。因此,对于药企而言,无论从费用还是前景的角度去看,mRNA疫苗都是风险较小、回报较高的选择,mRNA领域最早上市的产品有可能就是个性化的肿瘤疫苗。
mRNA疫苗在人体内顺利地被递送进入细胞是其发挥作用的基本保障,这一过程存在一定挑战。首先,血液和组织中无处不在的 RNA 酶是 mRNA 进入细胞的重要障碍,mRNA 极有可能在进入细胞之前被快速降解;其次,mRNA 需要穿过带负电荷的磷脂双分子层结构的细胞膜才可进入细胞内部。目前mRNA的递送系统可大致分为两类,即脂类或类脂材料和聚合物递送系统。
mRNA疫苗目前有两大应用领域,传染性疾病和癌症。
1)抗传染病的mRNA疫苗。发展预防性或治疗性疫苗来对抗传染性病原体,是遏制和预防流行病是最有效的手段。但是,过去的疫苗产品不能对抗像HIV、疱疹病毒或是呼吸道合胞病毒这些对人类健康造成巨大危害的病毒。除此之外,像2014-2016年先后爆发的埃博拉病毒和塞卡病毒这类突发病毒疾病,以及近期在国内蔓延的新型冠状病毒,传统疫苗也排不上用场。因此,发展更有效的疫苗刻不容缓。无数临床前的动物实验已经证明了mRNA疫苗对抗传染性病毒的药效。动物实验中安全性良好,其快速制备的特点也适用于传染病爆发的灵活应对,相对简单的生产工艺也便于质量控制。与蛋白免疫接种不同,mRNA疫苗能够引起强烈的CD4+或CD8+ 的T细胞应答。它们也与DNA免疫接种不同,在动物体内mRNA疫苗通过一两次低剂量接种就能够产生抗体。目前临床阶段开发的mRNA疫苗针对疾病包括HIV,流感病毒和狂犬病毒等。
2)抗肿瘤的mRNA疫苗。肿瘤疫苗和其他免疫疗法被认为是非常有前途的治疗恶性肿瘤的方法。肿瘤疫苗可以设计成靶向肿瘤细胞选择表达的相关抗原,比如,生长因子等。也可以靶向恶性肿瘤细胞突变产生的特有抗原。针对癌症的mRNA疫苗一般起治疗作用,而不是传统的预防作用,目的是促使细胞介导的应答,比如典型的T淋巴细胞应答,从而达到清除或者减少肿瘤细胞的目的。
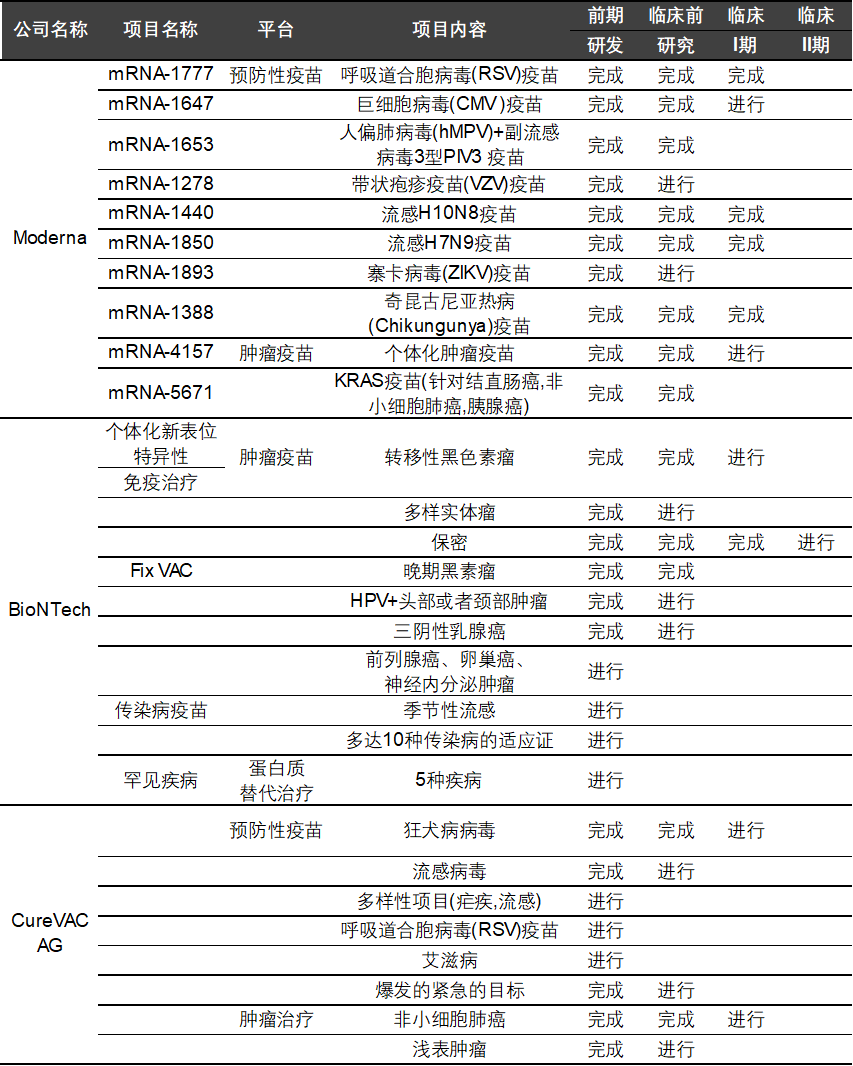
3、临床进展
目前,全球mRNA疫苗的开发主要集中在BioNTech、CureVac AG和Moderna三家公司,它们与各大药企合作。礼来联合CureVAC开发横跨多种类型癌症的mRNA疫苗产品。另外,辉瑞与BioNTech公司合作,宣布开发流感mRNA疫苗。三家公司主要研发管线及进展如下表所示。
4、国际参与方
1、Moderna
Moderna公司是一家成立于2010年的生物制药公司,2010年,创始人之一的Rossi发明了一种利用修饰的mRNA制作干细胞的方法,基于这项技术的巨大潜能,Rossi等人创立了Moderna。但使用非天然核糖核酸合成RNA的方法已有专利限制,经过大量尝试以后,Moderna开发了利用1-甲基假尿嘧啶合成RNA的方法。此后,Moderna又陆续开发了一系列新的mRNA合成技术。Moderna公司创立的mRNA技术平台帮助其成为目前全球最领先的mRNA公司之一,并获得了一系列行业独有的高质量mRNA候选药物,也建立起了自己的生态系统,数十个研究项目全面铺开。
目前Moderna公司的融资总额超过20亿美元,估值75亿美元。
目前Moderna结合先进的mRNA技术平台已经开发出了5种不同的疗法治疗不同领域的疾病,具体如下:
1)注射疫苗,Moderna目前开发了8种候选传染病疫苗和1种候选个性化癌症疫苗mRNA-4157。这种方法通过mRNA技术平台,将编码一种或多种病毒抗原蛋白的mRNA递送到体内细胞中,使细胞表达产生抗原蛋白,最终达到激活患者免疫系统的效果;
2)局部治疗,Moderna的局部治疗技术能够使特定蛋白质在患者身体内的靶组织中表达,解决了一些不希望特定蛋白质在全身表达的治疗问题。目前在免疫肿瘤学开发了2种候选药物,在心血管疾病中开发了1种候选药物;
3)IV全身治疗,Moderna使用全身静脉内(IV)递送mRNA药物的模式来刺激细胞产生可结合传染性病原体上靶标的特异性抗体。目前Moderna正处于IV全身治疗模式的研究阶段,还未开发出相关药物;
4)IV肝疗法,Moderna发现大量的疾病,包括许多罕见的遗传性疾病是由肝细胞表达的蛋白质缺陷引起的,因此通过将mRNA药物静脉内(IV)递送到肝脏,刺激治疗性蛋白质的产生,将是一种潜在的治疗方法。目前这项技术也在研发阶段;
5)吸入肺部治疗,Moderna通过与Vertex的合作,正在寻找将mRNA药物递送至肺部(通过吸入的方式)的治疗方法,以触发细胞产生功能性囊性纤维化传导调节因子蛋白(CFTR)。CFTR可以治愈囊性病人中的纤维化(CF)缺陷。这项技术目前也在研发阶段。
Moderna公司主要与生物制药公司、政府组织、基金会和研究所达成战略伙伴关系来推动mRNA的药物研发工作。从2010年成立以来的重要合作伙伴有:AstraZeneca、Alexion、Merck、Vertex等公司和研究机构。
2、CureVac
CureVac公司由Ingmar Hoerr博士于2000年创立,专注于RNA药物的研发与产业化,公司总部位于德国,有超过400名员工,公司是全球首家建立符合GMP标准的RNA生产线的公司。
CureVac公司拥有4种RNA技术平台,RNActive,RNArt,RNAntibody和RNAdjust。
1)RNActive是编码抗原的mRNA疫苗。在肿瘤治疗领域,通过mRNA编码多种常见的肿瘤相关抗原,激活免疫系统攻击肿瘤细胞。在研项目有肿瘤治疗性疫苗CV9202。该平台还有用于预防病毒感染的疫苗,如预防狂犬病、流感和HIV感染的疫苗。
2)RNArt是编码蛋白的RNA,可以补充或替换原来细胞中的蛋白,目前有一个用于治疗浅表肿瘤的项目处于临床前研究阶段。
3)RNAtibody是编码抗体的RNA,与BioNTech的技术类似,但CureVac的在研项目应是编码单抗而不是双抗。细胞内表达的抗体可以靶向胞内的蛋白,阻断蛋白之间的相互作用,这是目前的抗体药物无法做到的。RNA在细胞内编码的蛋白有人体的翻译后修饰,更易于制备多种抗体的混合物,有更好的药代动力学,可以保持高AUC,能持续、稳定地产生抗体。再者,用RNA生产抗体更简单、快速,CMC工艺稳定性更好。
4)RNAdjuvant是促进免疫反应的Long non-coding RNA。用于激活免疫反应。
3、BioNTech
BioNTech是一家德国生物技术公司,成立于2008年,员工650人。其创始人Ugur Sahin是德国美因茨大学的教授,也是Ganymed的创始人和Claudin 18.2抗体的研究发起者。
BioNTech主要研发mRNA肿瘤治疗性疫苗,也有 CAR-T细胞治疗、双特异抗体及小分子药物项目。
BioNTech在肿瘤疫苗方面有3种mRNA药物平台:
1)FixVAC®是多种肿瘤相关抗原混合的肿瘤疫苗,不具有个性化;
2)RNA-Warehouse是制作好包含多种抗原的疫苗库,鉴定病人的肿瘤特异性抗原后,选取对应抗原的疫苗治疗,有一定的个性化性质;
3)IVAC®-Mutanome是通过测序得到病人所有的肿瘤特异性抗原,然后以此制定个性化的疫苗方案,再合成表达相应蛋白的mRNA作为疫苗,是个性化程度最高的疫苗。
2018年8月,辉瑞以1.2亿美元的首付款、3.05亿美元的里程款牵手BioNTech开发mRNA流感疫苗;2019年1月,赛诺菲延长与BioNTech的合作协议,投资8000万欧元(约合9150万美元),共同开发基于mRNA技术治疗实体瘤的肿瘤免疫候选药物,并将之推向临床最终实现商业化。目前BioNTech虽还处于亏损状态,但2018年营收已经达到了1.28亿欧元,这些营收主要来自于与药企巨头之间的合作。
BioNtech于2019年10月在纳斯达克上市,发行价15美元,最高曾达到48.8美元,目前市价29.5美元,市值接近70亿美元。
五、国内参与方
1、斯微生物
斯微生物于2016年由美国的海归博士团队在上海张江药谷创建, 致力于打造中国领先的mRNA药物平台和产品管线。2017年7月,经过与康奈尔大学休斯顿卫理公会医院(Houston Methodist Hospital)协商,斯微生物正式获得创始人之一沈海法教授发明的mRNA递送技术相关专利的全球独家授权。
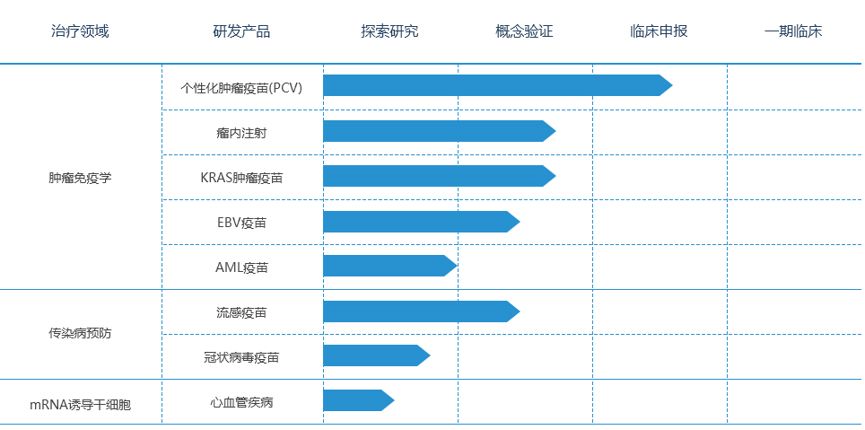
斯微生物目前的治疗领域集中在肿瘤和传染性疾病两大领域,研发管线如下图所示:
1)个性化肿瘤疫苗PCV:斯微正在创建基于mRNA的个性化肿瘤疫苗,为每一名患者提供量身定制的肿瘤疫苗。通过测序,确定了患者肿瘤细胞独有突变,也就是新肿瘤新抗原,新抗原可以帮助免疫系统区分肿瘤细胞和正常细胞。利用我们内部生物信息学团队开发的算法,预测出能够引起强免疫应答的多条新生抗原,然后将其装载到一条mRNA分子上。mRNA疫苗能够在患者的DC细胞中表达所需的新生抗原,并被MHC分子递呈,进而激活抗原特异性的T细胞,对肿瘤细胞进行特异性杀伤。
2)瘤内注射:目前的免疫检查点抑制剂对“冷”肿瘤效果差。斯微生物通过mRNA技术编码免疫激活分子,结合检查点抑制剂,激活肿瘤免疫微环境,对“冷”肿瘤发挥治疗作用。工作重点是增强特异的抗肿瘤T细胞反应,将免疫抑制微环境的“冷”肿瘤转化为免疫“热”肿瘤,从而产生高效的抗癌免疫反应。
2、美诺恒康
美诺恒康成立于2013年,以外包服务起家。随着肿瘤疫苗成为生物技术领域的新晋宠儿,美诺恒康转战肿瘤疫苗领域,着手研发mRNA肿瘤疫苗。短短1年多,美诺恒康的mRNA肿瘤疫苗便完成了概念验证。
在临床前动物药效学实验中,美诺恒康的mRNA肿瘤疫苗在胰腺癌、直肠癌和肝癌等领域取得了良好的肿瘤抑制生长效果。
六、展望
mRNA疫苗生产工艺简单、合成快速、成本较低,本身具有激活免疫反应的佐剂作用;且在细胞质中翻译不进入细胞核,没有整合宿主基因组的风险;能够作为内源性抗原,被mRNA分子提呈激活CTL反应杀伤肿瘤细胞;同时作为核酸本身具有激活免疫反应的佐剂作用。在癌症基因测序和抗原新表位发现技术发展的基础上,mRNA疫苗成为肿瘤个性化疫苗的最佳选择。
但需要看到的是,尽管在融资领域Moderna、CureVac等公司融资金额已经非常巨大,但从临床进展来看,最快的仅进展到II期,由于动物环境和人体环境差异较大,递送系统在人体内效率、mRNA稳定性等都需要大量临床实验予以进一步验证。
在解决mRNA的稳定性和递送问题后,除了用作疫苗,mRNA也可作为蛋白质补充或替代疗法治疗其他多种疾病,这有望能成为一种非常理想的药物形式。期待随着生物信息学的应用,对更多mRNA稳定序列的分析和预测,以及法律法规的不断完善,可以加快促进mRNA疫苗和药物的发展。
本文来源于信熹资本,贝壳社经授权发布。


文章评论(0)