首个国产减肥针上市后,它在ADC、罕见病等领域持续发力
随着首个国产减肥针上市、乌司奴单抗冲首仿,以及更多GLP-1、ADC创新产品持续推进,华东医药正从仿制药企转型为创新药企。未来随着仿制药及创新药的不断放量,华东医药将进入发展快车道。
更多GLP-1产品加速国产替代
肥胖症被WHO定为十大慢性病之一。在全球,到2023年,全球减重药物销售量将达到1000亿美元。在中国,有超过50%的成年居民超重或肥胖;未成年居民方面,6-17岁超重/肥胖率达到19%、6岁以下为10.4%。到2032年,中国GLP-1减重药品市场将达到486亿元。
利拉鲁肽注射液原研厂家是诺和诺德,核心专利在2023年底到期。其糖尿病适应症2010年获FDA批准,2011年在中国获批;肥胖或超重适应症于2014年获得FDA批准,暂未在中国获批。据诺和诺德2022年报,其利拉鲁肽注射液(商品名:诺和力,适应症为糖尿病)2022年全球销售额约为人民币123.28亿元,其中中国市场销售额约为人民币14.79亿元。其利拉鲁肽注射液(商品名:Saxenda,适应症为肥胖或超重)2022年全球销售额总计约为人民币106.81亿元。在中国,2023年上半年GLP-1受体激动剂类药物在公立医疗机构和城市实体药店终端销售额合计近40亿元,同比增长超50%,其中利拉鲁肽注射液销售额近10亿元。
本土企业利拉鲁肽仿制药方面,临床3期及以上的企业已超过10家,有万邦医药、爱美客、双鹭药业、派格生物、信立泰等,其中和泽医药、正大天晴、翰宇药业的利拉鲁肽已经提出上市申请。目前除华东医药首款获批上市的国产利拉鲁肽注射液,还有通化东宝利拉鲁肽注射液生物类似药于2023年12月1日获批上市。
2023年3月,华东医药的利拉鲁肽注射液获批2型糖尿病适应症,7月肥胖或超重适应症获批。目前,华东医药针对其上市产品利拉鲁肽注射液的(含糖尿病适应症、肥胖或超重适应症)的研发投入约3.22亿元。分析指,华东医药利拉鲁肽注射液在国内企业中处于第一梯队,面对广阔的市场空间,上市后将快速放量,提升业绩增长的同时也将加速国产替代。此外,仁会生物的贝那鲁肽注射液于2023年7月获批上市,将加入中国GLP-1类产品竞争。
除了利拉鲁肽注射液,在全球减重及降糖领域,走在前面的还有度拉糖肽、司美格鲁肽、替尔泊肽等产品。礼来和诺和诺德依然是头部玩家。如今,这两个头部企业开始布局中国市场。2023年6月,诺和诺德司美格鲁肽注射液减重适应症向国家药监局提交上市申请;8月,礼来替尔泊肽注射液减重适应症的注册申请获国家药监局受理。此外,诺和诺德司美格鲁肽核心专利将于2026年到期,包括华东医药在内的多家企业布局司美格鲁肽仿制药。华东医药公告称,其司美格鲁肽注射液正在开展3期临床(用于2型糖尿病)。另有石药集团、九源基因、华东医药、丽珠集团、联邦制药等多家企业布局司美格鲁肽。其中丽珠集团的司美格鲁肽也将进入临床3期。
本土还有信达生物的GCGR/GLP-1R双重激动剂玛仕度肽(IBI 362)具有同类最佳药物潜力,目前玛仕度肽9mg在中国肥胖受试者中的3期临床研究预计将于2023年年底启动。6mg用于减重的首个NDA预计在2023年底至2024年初提交。
此外,本土创新药巨头恒瑞医药在降糖/减重领域,有5款GLP-1R相关新药进入临床研究。其中诺利糖肽为利拉鲁肽的衍生物,与市面同类药物相比,诺利糖肽不良反应发生率低。目前已经完成肥胖和2型糖尿病2期临床,马上进入3期临床。另有两款双靶点药物:GIPR/GLP-1R双靶点激动剂HRS9531(适应症:2型糖尿病、肥胖,2期临床)、GCGR/GLP-1R双靶点激动剂 SHR-1816(适应症:2型糖尿病,1期临床),值得关注。
本土积极开发GLP-1类创新药的还有:甘李药业(自研产品GZR18目前已完成了IIb期临床试验首例受试者给药)、中国生物制药(1款利拉鲁肽注射液已提交上市申请)等。
除了首个国产减肥针上市,华东医药还有多款减重降糖药物在研。
HDM1002:2023年9月13日,华东医药自主研发的1类新药口服小分子GLP-1受体激动剂HDM1002(用于超重或肥胖人群的体重管理的适应症)获批临床(默示许可)。临床前研究显示,HDM1002可强效激活GLP-1受体,诱导环磷酸腺苷(cAMP)产生,在改善糖耐受、降糖和减重方面具有强效作用,安全性良好。
DR10624(3靶点):DR10624为全球首创(first-in-class)的一种靶向GLP-1受体(GLP-1R)、GCG受体(GCGR)和FGFR1c/Klothoβ(FGF21R)的长效三靶点激动剂。临床前动物研究显示,DR10624降脂、减重、降糖等疗效明显。2023年7月30日,华东医药宣布其控股子公司道尔生物的注射用DR10624(超重或肥胖人群的体重管理适应症)的临床试验申请获批。DR10624糖尿病适应症9月8日获批临床(默示许可)、重度高甘油三酯血症适应症的中国IND已于2023年8月递交。另外,2023年7月,该药治疗肥胖症的1期多次递增剂量给药(MAD)临床试验的首例受试者给药在新西兰完成。
SCO-094(双靶点):SCO-094是GLP-1R/GIPR双靶点激动剂,具有较强靶点结合活性和细胞生物活性,在降糖、减肥、改善肝功能、降低甘油三酯和抑制肝脏脂肪变性方面的效果强大。该药由华东医药从日本SCOHIA引入,同时还引入其衍生产品。2023年2月全资子公司杭州中美华东制药有限公司宣布获得 SCO-094 及其衍生产品在全球(包括日本)的独家开发、生产及商业化权益。该药的1期临床试验已在英国开展。
此外,华东医药的德谷胰岛素注射液(用于2型糖尿病)正在开展3期临床。
目前,华东医药在GLP-1靶点进行密集布局,已构筑口服+注射剂、长效+多靶点、创新药+生物类似药的产品矩阵,未来势必在竞争火热的减肥降糖赛道占得一方天地。
多款ADC布局肿瘤赛道
华东医药1类新药迈华替尼片于2023年5月被纳入突破性治疗品种(用于EGFR罕见突变的晚期非小细胞肺癌)。用于EGFR敏感突变的晚期非小细胞肺癌3期临床试验已成功达到主要终点。目前华东医药针对迈华替尼片项目的直接研发投入约为23,874万元。
ADC药物方面,2020年10月,华东医药从美国ImmunoGen引进全球首创ADC新药索米妥昔单抗注射液(ELAHERE),上市申请于2023年10月25日获国家药品监督管理局受理,有望在2024年获批上市。据美国ImmunoGen财报,2023年ELAHERE第三季度美国净销售额为1.052亿美元(约7.5166亿元人民币),前三季度销售额达2.12亿美元(约15.1476亿元人民币)。
目前国内获批上市的ADC药物有7款,其中6款为进口产品,1款为国产产品。国内目前已有30多个不同靶点的ADC药物在研,HER2、Claudin 18.2、Trop-2等处于布局靶点前三。布局企业有恒瑞医药、百利天恒、科伦博泰、迈威生物、荣昌生物、乐普生物、百奥泰、石药集团、信达生物、康宁杰瑞、君实生物、百济神州、康诺亚、浙江医药等。其中恒瑞医药有6款ADC处于临床阶段。百利天恒、科伦博泰、巨石生物等布局4款,有药物进入3期临床。巨石生物有4款ADC进入临床,其中CLDN18.2 ADC(SYSA1801)和Nectin4 ADC(SYS6002)授权给美国公司在大中华地区、欧美等地的开发及商业化权利,实现出海。另有HER2 ADC已取得附条件上市许可,可以以2期临床结果申请附条件上市,目前处于2/3期临床。随着新靶点不断涌现,以及老靶点的复杂竞争,未来国内ADC赛道竞争将会更加激烈。另外随着国产新药的上市,国产替代也将提上日程。
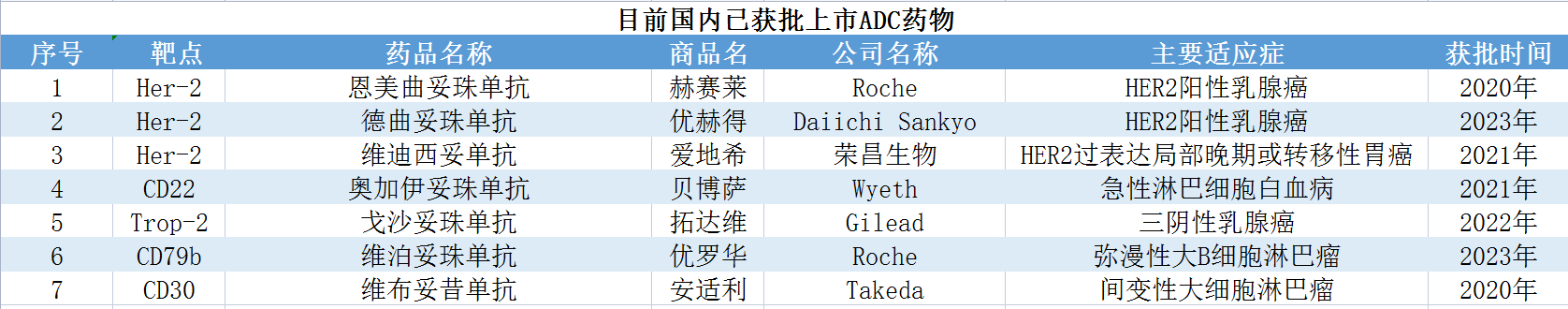
数据来源:公开资料等,贝壳社制图
除了引入美国的ADC产品,华东医药还自主研发ADC。首个自主研发ADC项目HDM2005已于2023年第一季度完成PCC确认,目前正持续推进IND开发,将于2024年内申报临床。其他肿瘤管线还有:首个自主研发PROTAC项目HDM2006已于2023年9月获得PCC确认,并进入IND开发阶段。2023年第四季度预计还将有1款肿瘤自主创新产品获得PCC确认。
更多罕见病药物研发中
乌司奴单抗生物类似药HDM3001(QX001S):2023年8月,华东医药与参股企业荃信生物合作开发的乌司奴单抗生物类似药HDM3001(用于成年中重度斑块状银屑病的治疗)正式递交生物制品许可申请(BLA)申请。目前国内暂无乌司奴单抗生物类似药获批上市,华东医药乌司奴单抗生物类似药HDM3001(QX001S)将冲国内首仿。
乌司奴单抗在治疗中重度银屑病时更高效便捷,清除率更高。强生原研药Stelara®2022年全球销售额为97亿美元,同比增长6.5%;2023上半年全球销售额为52.41亿美元,同比增长7.2%。原研药Stelara®2022年进入国家医保后,当年前三季度院内销售额首次破亿,同比大涨1980%。中国银屑病药物市场规模预计将于2030年增至95亿美元,华东医药HDM3001(QX001S)未来上市,将打破原研药霸主格局,广阔市场空间等待开拓。本土布局乌司奴单抗生物类似药的还有百奥泰生物制药股份有限公司,2023年11月底,其宣布乌司奴单抗生物类似药BAT2206的3期临床研究达到了主要终点;石药集团有乌司奴单抗生物类似药SYSA-1902于今年1月启动了3期临床试验。
此外还有用于治疗系统性红斑狼疮的创新药HDM3002(PRV-3279),IND申请已于2023年4月获得CDE批准,正式加入IIa期MRCT试验(PREVAIL-2)。还有2022年从美国Kiniksa引进的全球创新产品ARCALYST®,用于治疗冷吡啉相关的周期性综合征(CAPS)。2023年6月底公司已完成复发性心包炎(2023年9月《第二批罕见病目录》收录)适应症的中国Pre-BLA递交。还有自主研发的GLP-1R/GIPR双靶点长效多肽类激动剂HDM1005已进入IND研究阶段,2024年初递交IND申请。
此外,华东医药还布局创新医疗药械:与美国MediBeacon, Inc.联合开发HD-NP-102(肾小球滤过率动态监测系统和MB-102注射液),2022年7月,NMPA正式受理该系统的医疗器械注册申请,目前处于审评阶段。MB-102注射液为全球创新药,2023年4月完成中国pre-NDA递交。2023年6月递交美国PMA,FDA于7月正式受理。另外还与比利时等海外公司联合开展全球创新型壳聚糖医美产品皮肤动能素(KiOmed Skin Booster)等医美产品的临床试验。
参考资料:
1华东医药官网.
2.《百亿美金重磅品种将迎国内首仿,银屑病治疗格局生变》,药融圈PHARNEX,2023-08-18.
3.《冲击149亿市场,减重创新药又+1!华东医药再“卷”减重赛道》,药融云,2023-09-14.
4.《华东医药股份有限公司2023第三季度报告 》,证券时报, 2023-10-25.


文章评论(0)